题目内容
(15分)海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。
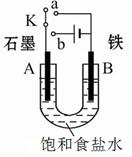
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式 。
(2)图甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
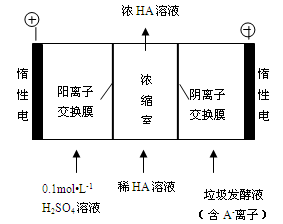
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是_______、______________。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH_ g。
Ⅲ.下图是工业上生产镁的流程。
(1)写出下列反应的化学方程式:
①沉淀池: ; ②电解: ;
(2)整个生产流程中循环使用的物质是 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项: 。
Ⅰ.(1)2Cl--2e-=Cl2 ↑ (2)NaOH和NaCl (3)阻止气体通过
Ⅱ.(1)NaOH溶液 Na+ (2)80
Ⅲ.(1)①MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
②MgCl2(熔融)  Mg+Cl2↑
Mg+Cl2↑
解析

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
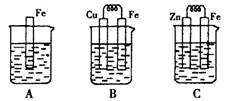
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填字母)。
| A.铜 | B.钠 |
| C.锌 | D.石墨 |
下列物质中最简式相同,但既不是同系物,也不是同分异构体的是
A. 和 和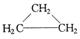 | B.乙炔和苯 |
C. 和 和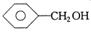 | D.葡萄糖与麦芽糖 |

 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
 (填 “变大”“变小”或“不变”)。
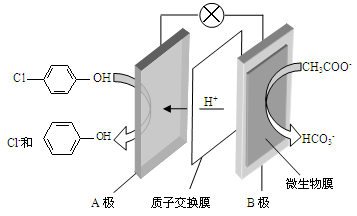
(填 “变大”“变小”或“不变”)。 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。