题目内容
【题目】为测定放置己久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,罝于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是__________________。
(2)方案二:按下图装置进行实验,并回答以下问题。
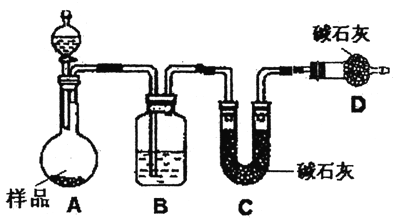
①实验前先____________。分液漏斗中应该装稀_______ (盐酸或硫酸)。D装置的作用是____________。
②实验中除称量样品质量外,还需称_____装置前后质量的变化(填装置的字母代好)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是___________。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算。
①采用该方法判断沉淀是否完全的方法是_______________。
②如加入试剂改为氢氧化钡,已知称得样品9. 5g,干燥的沉淀质量为19. 7g,则样品中碳酸钠的质量分数为_______________ (计算结果保留两位有效数字)。
【答案】 保证NaHCO3全部分解 检査装置的气密性 硫酸 防止空气中水蒸气、CO2进入C管 C A、B中的CO2无法全部进入C中被吸收 将反应后小烧杯静置,上层清液中,再滴加BaCl2溶液少许,若无白色沉淀生成说明沉淀完全 56%
【解析】(1)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;(2)①该方案是要获得产生的CO2的质量,在实验前要检查装置的气密性;盐酸具有挥发性,会影响实验结果,所以选择稀硫酸;D干燥管中的碱石灰吸收空气中的水蒸气、二氧化碳,防止进入C被吸收,减少误差;②根据所产生的CO2的质量及样品质量,分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数,所以需称量C装置前后质量变化判断生成二氧化碳的质量;③装置A、B中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差;(3)①实验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;②如加入试剂改为氢氧化钡,此时发生如下反应Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O。设碳酸钠和碳酸氢钠的物质的量分别是xmol、ymol,则106x+84y=9.5、197x+197y=19.7,解得x=y=0.05,所以样品中碳酸钠的质量分数为106/190×100%=56%。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】已知某化学反应的平衡常数表达式为K=[c(CO2)·c(H2)] /[c(CO)·c(H2O)],在不同的温度下该反应的平衡常数值分别为:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述错误的是
A. 该反应的化学方程式是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在1L的密闭容器中加入CO2和H2各1mol,再把温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 若平衡浓度关系符合c(CO2)/3c(CO)=c(H2O)/5c(H2),可判断此时温度是1000℃