题目内容
13.利用氯气将甲烷取代制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图,根据要求填空: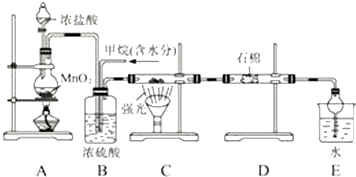
(1)B装置有三种功能:①控制气体流速;②使氯气与甲烷混合均匀;③干燥混合气体.
(2)D装置的石棉中均匀混有KI粉末,其作用是吸收过量的Cl2.E装置的作用是CD(填编号).
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(3)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为分液.该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为AB(填编号).
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3
(4)在C中,强光一段时间后硬质玻璃管内有黑色颗粒产生,写出置换出黑色颗粒的化学方程式CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl.
(5)写出A中反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(6)设$\frac{V(C{I}_{2})}{V(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则x的取值范围为x≥4.
(7 )一气态烷烃和一气态烯烃组成混合气体共10g,混合气体的密度是相同条件下氢气的12.5倍,该混合气体通过溴水时,溴水增重8.4g,求该混合气体的组成甲烷、乙烯.
分析 (1)气体可以在B中充分混合,浓硫酸具有吸水性,可以干燥混合气体;
(2)氯气能将碘化钾氧化为碘单质;装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸;
(3)HCl溶于水生成盐酸,与有机物相互不溶解;反应生成的产物中一氯甲烷为气体,还会剩余未反应的甲烷;
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒为炭黑,说明有碳生成;
(5)A中二氧化锰与浓盐酸反应生成氯气和氯化锰和水;
(6)1mol氯气可取代1molH原子生成1molHCl,欲获得最多的氯化氢,则甲烷中的H原子被完全取代;
(7)依据混合气体的密度是相同条件下氢气的12.5倍,计算混合气体的平均相对分子质量为28,据此判断存在甲烷,依据烯烃与溴发生加成反应,而甲烷不与溴水反应,所以溴水增重的质量为烯烃,结合质量根据n=$\frac{m}{M}$计算混合气体的总物质的量、甲烷的物质的量,进而计算烯烃的物质的量,再计算烯烃的相对分子质量,结合组成通式CnH2n确定其组成.
解答 解:(1)B装置有三种功能:①控制气体流速②使氯气与甲烷混合均匀③干燥混合气体;
故答案为:使氯气与甲烷混合均匀;干燥混合气体;
(2)氯气能够与碘化钾发生反应,所以可以用碘化钾吸收过量的氯气;装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸;
故答案为:吸收过量的氯气;CD;
(3)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:分液;A、B;
(4)CH4与Cl2在强光照射下生成的黑色小颗粒为炭黑,所以在强光照射下可发生CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,
故答案为:CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl;
(5)A中二氧化锰与浓盐酸反应生成氯气和氯化锰和水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(6)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设$\frac{V(C{I}_{2})}{V(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则应保证甲烷被完全取代,x应大于或等于4,
故答案为:x≥4;
(7)混合气体的密度是相同条件下氢气的12.5倍,则混合气体的平均相对分子质量=12.5×2=25,烯烃的最小相对分子质量为28,故该混合气体一定含有CH4,烯烃与溴发生加成反应,而甲烷不与溴水反应,故溴水增重8.4g为烯烃的质量,则甲烷的质量=10g-8.4g=1.6g,其物质的量=$\frac{1.6g}{16g/mol}$=0.1mol,混合气体的物质的量=$\frac{10g}{25g/mol}$=0.4mol,故烯烃的物质的量=0.4mol-0.1mol=0.3mol,则烯烃的相对分子质量=$\frac{8.4g}{0.3mol}$=28,令烯烃组成为CnH2n,则12n+2n=28,解得n=2,故该混合气体为甲烷、乙烯;
故答案为:甲烷、乙烯.
点评 本题考查了氯气的制备和甲烷的性质,明确氯气制备原理、甲烷与氯气发生取代反应原理是解题关键,题目难度中等.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 甘油 | B. | 醋酸 | C. | 甲醇 | D. | 乙醛 |
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
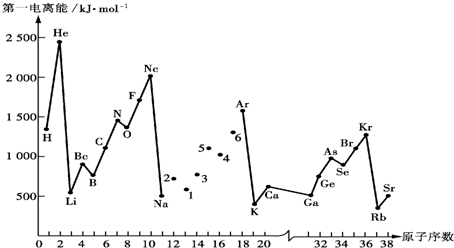
①将Na-Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图象.从上图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小
②上图折线中数字5代表元素在周期表中的位置是第三周期ⅤA族;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
②某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(3)已知:波长为300nm的紫外光的光子所具有的能量约为399kJ/mol.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
| C--C | C--N | C--S | |
| 键能 KJ/mol | 347 | 305 | 259 |
| A. | BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2 | |
| B. | BeF2分子的立体结构为直线形 | |
| C. | SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子 | |
| D. | 在气相中,BeF2是直线形而SF2是V形 |
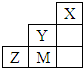
| A. | 非金属性:Y>M>Z | |
| B. | Y、Z、M的氢化物分子各原子最外层均满足8e-稳定结构 | |
| C. | 原子半径:M>Z>Y | |
| D. | Y 的最高价氧化物的水化物的化学式为HYO4 |
(1)该反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂用量/g | KMnO4酸性溶液浓度mol/L | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响 (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的 影响; |
| ② | ||||
| ③ | 323 | |||
| ④ |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(4)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色.(反应热效应不明显,可忽略不计),该反应的反应速率迅速加快的主要原因可能是反应生成的MnSO4作为该反应的催化剂.
| A. | 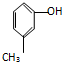 和 和  | B. | 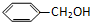 和 和  | ||
| C. | (CH3)2C(OH)CH2CH3 和CH3CH2OH | D. | CH3CH2OH 和 CH3CH2OCH2CH3 |
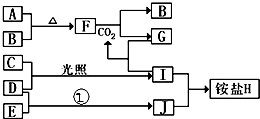 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应. .
. 2NH3的化学方程式.
2NH3的化学方程式.