题目内容
下列说法正确的是
① pH=2和pH=1的HNO3中c(H+)之比为1∶10
②Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
③同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
④分别向100 mL 0.1 mol·L-1的醋酸和10 mL 1.0 mol·L-1的醋酸中加入KOH,恰好中和所需的KOH一样多
① pH=2和pH=1的HNO3中c(H+)之比为1∶10
②Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
③同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
④分别向100 mL 0.1 mol·L-1的醋酸和10 mL 1.0 mol·L-1的醋酸中加入KOH,恰好中和所需的KOH一样多
| A.①④ | B.①③④ | C.①② | D.①②③ |
B
试题分析:题中碳酸钠溶液中碳酸根水解,所以c(Na+)与c(CO32-)之比不为2:1;盐类水解能促进水的电离,而酸或碱抑制水电离; 100 mL 0.1 mol·L-1的醋酸和10 mL 1.0 mol·L-1的醋酸中醋酸的物质的量相等,所以恰好中和时所需的KOH一样多。

练习册系列答案
相关题目



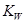 表示水的离子积,a表示水的电离度,能使
表示水的离子积,a表示水的电离度,能使 的值增大的是
的值增大的是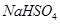


 H++OH-,在不同温度下其平衡常数为Kw(25 ℃)=1.0×10-14,Kw(35 ℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为Kw(25 ℃)=1.0×10-14,Kw(35 ℃)=2.1×10-14。则下列叙述正确的是