题目内容
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |
(1)13 (2)< NH4++H2O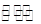 NH3·H2O+H+ (3)C (4)<
NH3·H2O+H+ (3)C (4)<
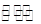 NH3·H2O+H+ (3)C (4)<
NH3·H2O+H+ (3)C (4)<试题分析:(1)求溶液的pH,就是求溶液中氢离子浓度的负对数,25 ℃时,0.1 mol·L-1NaOH溶液的氢氧根离子浓度为
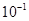 ,那么氢离子浓度就为
,那么氢离子浓度就为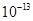 ,所以其pH=13 (2)氯化铵是强酸弱碱盐,水解显酸性,因此其pH<7,可以用以下方程式表示: NH4++H2O
,所以其pH=13 (2)氯化铵是强酸弱碱盐,水解显酸性,因此其pH<7,可以用以下方程式表示: NH4++H2O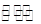 NH3·H2O+H+ (3)上述两种溶液等体积混合后,得到等物质的量的氨水和氯化钠,因此有C;(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1=
NH3·H2O+H+ (3)上述两种溶液等体积混合后,得到等物质的量的氨水和氯化钠,因此有C;(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1=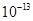 ;0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2=
;0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2=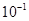 ,,则C1<C2。
,,则C1<C2。
练习册系列答案
相关题目
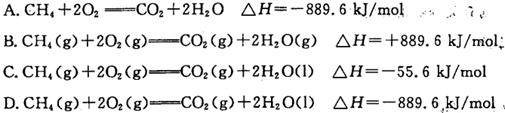
 NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1