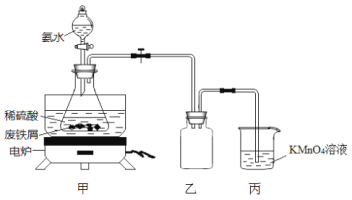
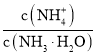题目内容
【题目】用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除了烧杯外,还需要的玻璃仪器有_____________ 、____________、和_____________。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时眼睛应________.
③有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.50 |
2 | 20.00 | 1.20 | 21.20 |
(3)计算纯度:烧碱样品的纯度是_______。
(4)误差分析(填“偏高”,“偏低”,或“无影响”)
a. 酸式滴定管用蒸馏水洗后未用标准液润洗,就直接装入标准液,造成测定结果____________。
b、锥形瓶水洗后,又用待测液润洗,,测定结果____________。
c、用碱式滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,造成测定结果____________。
d、滴定前,锥形瓶用水洗涤后,锥形瓶中残留水未干燥,造成最终结果___。
e、酸式滴定管,滴定前仰视读数,滴定后平视读数,造成测定结果__________。
【答案】1 000 mL容量瓶 胶头滴管 玻璃棒 酸 注视锥形瓶中溶液颜色的变化 80.% 偏高 偏高 偏低 无影响 偏低
【解析】
用中和滴定法测定某烧碱样品的纯度时,反应原理为HCl+NaOH=NaCl+H2O,实验步骤为配制待测液→滴定→计算→误差分析,需要的实验仪器有一定规格的容量瓶、烧杯、滴定管、托盘天平、胶头滴管、玻璃棒、锥形瓶,计算和误差分析时,根据公式![]() ,
,![]() 进行分析解答。
进行分析解答。
(1)配制1000mL待测液时,需要用到的玻璃仪器有烧杯、玻璃杯、胶头滴管、1000mL的容量瓶,故答案为:1000mL的容量瓶、胶头滴管、玻璃杯;
(2)①盐酸标准液为酸性溶液,应使用酸式滴定管盛装,故答案为:酸;
②滴定时,左手控制滴定管的活塞,右手不停的向同一方向摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,故答案为:注视锥形瓶中溶液颜色的变化;
(3)根据表格数据可知,消耗盐酸的平均体积为![]() ,则20mL待测液中NaOH的物质的量为n(NaOH)=c(NaOH)·V(NaOH)=c(HCl)·V(HCl)=0.1000mol·L-1×0.02L=0.002mol,则样品中m(NaOH)=n(NaOH)·M(NaOH)=(0.002×50)mol×40g/mol=4g,因此烧碱样品的纯度为
,则20mL待测液中NaOH的物质的量为n(NaOH)=c(NaOH)·V(NaOH)=c(HCl)·V(HCl)=0.1000mol·L-1×0.02L=0.002mol,则样品中m(NaOH)=n(NaOH)·M(NaOH)=(0.002×50)mol×40g/mol=4g,因此烧碱样品的纯度为![]() ,故答案为80%;
,故答案为80%;
(4)a.酸式滴定管用蒸馏水洗后未用标准液润洗,直接装入标准液会是盐酸标准液浓度降低,消耗的盐酸标准液体积变大,从而使得计算出NaOH的质量偏大,造成测定结果偏高,故答案为:偏高;
b.锥形瓶水洗后,又用待测液润洗,导致待测液含量变大,消耗的盐酸标准液体积变大,从而使得计算出NaOH的质量偏大,造成测定结果偏高,故答案为:偏高;
c.用碱式滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,取得的待测液减小,则消耗的盐酸标准液体积变小,从而使得计算出NaOH的质量偏小,造成测定结果偏低,故答案为:偏低;
d.滴定前,锥形瓶用水洗涤后,锥形瓶中残留水未干燥,对实验结果没有影响,故答案为:无影响;
e.酸式滴定管,滴定前仰视读数,滴定后平视读数,读得消耗的盐酸标准液体积变小,从而使得计算出NaOH的质量偏小,造成测定结果偏低,故答案为:偏低。

【题目】(1)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
括号内为杂质 | 除杂试剂 | 操作 | |
1 | 乙烷(乙烯) | _____ | _____ |
2 | 乙酸乙酯(乙酸) | _____ | _____ |
3 | 苯(苯酚) | _____ | _____ |
4 | 乙醇(水) | _____ | _____ |
(2)以五倍子为原料可制得A,A结构简式如图所示,回答下列问题:
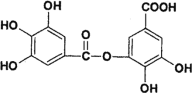
①A的分子式为_______________。
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
③写出A与过量NaOH溶液反应的化学方程式___________。