题目内容
【题目】工业生产硝酸铵的流程如下图所示:
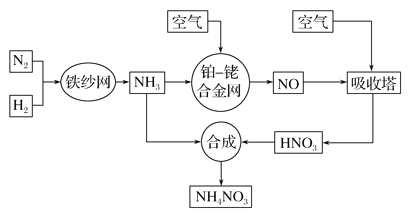
请回答下列问题:
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。
①在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“大于”、“小于”或“等于”)92.4 kJ。
②为提高H2的转化率,实际生产中宜采取的措施有________(填字母)。
A.降低温度
B.最适合催化剂活性的适当高温
C.适当增大压强
D.减小压强
E.循环利用和不断补充氮气
F.及时移出氨
(2)该流程中铂—铑合金网上的氧化还原反应为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K________(填“增大”、“减小”或“不变”),理由是__________________________________________________________________。
②若其他条件不变,则下列图像正确的是________(填字母)。

【答案】 小于 CEF 减小 氨的催化氧化反应是放热反应,升高温度,平衡逆向移动,K会减小 ABC
【解析】(1)①在1.01×105kPa和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ;②N2(g)+3H2(g)2NH3(g)△H=-92.4 kJ/mol,该反应正反应为体积缩小的反应,A.降低温度,反应速率降低,不选用;B.最适合催化剂活性的适当高温,催化剂对平衡没有影响,不选;C.适当增大压强,平衡正向移动;可选;D.减小压强,平衡逆向移动,不选;E.循环利用和不断补充氮气,提高H2的转化率,可选;F.及时移出氨平衡正向移动;故选CEF。(2)①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K减小,氨的催化氧化反应是放热反应,升高温度,平衡逆向移动,K会减小;②A、增大压强平衡逆移,所以压强越大NH3的转化率越小,与图象相符,故A正确;B、加催化剂不改变平衡,所以O2的含量不变,反应速率增大,到达平衡的时间变小,与图象相符,故B正确;C、增大压强平衡逆移,所以压强越大NO越小,与图象相符,故C正确;D、升高温度,平衡逆向移动,H2O的含量降低,与图象不符,故选ABC。

【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
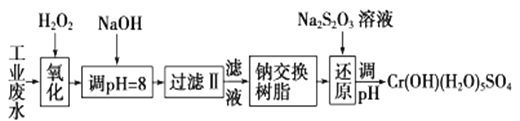
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.HNO3 B.Na2O2 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填ABCD序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________(填ABCD序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
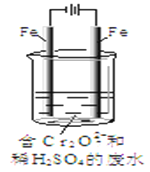
(3)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(4)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
