题目内容
(6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:

(1) 不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)如用0.50 mol·L-1盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”)
(3)实验得到表中的数据:
经数据处理,t2-t1=3.4℃。则该实验测得的中和热 ΔH =________。

(1) 不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)如用0.50 mol·L-1盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”)
(3)实验得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
Cu传热快,热量损失大 偏大 ΔH=-56.8 kJ·mol-1。
(1)因为铜是金属,是热的良导体,传热快,热量损失大,所以不能用铜丝搅拌棒代替环形玻璃搅拌棒。
(2)氢氧化钠固体溶于水会放热,所以测的的中和热偏大。
(3)反应中放出的热量是(m1+m2)×c×(t2-t1)=0.418(t2-t1)kJ,反应中生成水是0.025mol,所以中和热是△H=-0.418(t2-t1)/0.025kJ/mol=-56.8 kJ·mol-1。
(2)氢氧化钠固体溶于水会放热,所以测的的中和热偏大。
(3)反应中放出的热量是(m1+m2)×c×(t2-t1)=0.418(t2-t1)kJ,反应中生成水是0.025mol,所以中和热是△H=-0.418(t2-t1)/0.025kJ/mol=-56.8 kJ·mol-1。

练习册系列答案
相关题目
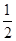 O2(g)=== ZnO(s),ΔH=" -348.3" kJ·mol-1,
O2(g)=== ZnO(s),ΔH=" -348.3" kJ·mol-1, 2HI(g) △H=-9.48 kJ·mol-1
2HI(g) △H=-9.48 kJ·mol-1  ;HCl(aq)与NaOH反应的
;HCl(aq)与NaOH反应的 ,则HCN在水溶液中电离的
,则HCN在水溶液中电离的 等于
等于



 O2(g)=CO(g)
O2(g)=CO(g)  H1=-110.5 kJ/mol
H1=-110.5 kJ/mol