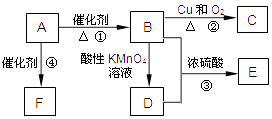
题目内容
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面.
查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如图:
(1)操作①的名称是 .
(2)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有
(3)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的 .
(4)反应器Ⅱ中发生反应的离子方程式为 .
(5)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由 .
【答案】
(1)过滤
(2)强氧化性
(3)为了产物能得到HClO4而不是NaClO4
(4)4OH﹣+SO2+2ClO2=2ClO2﹣+SO42﹣+2H2O
(5)不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4
【解析】解:NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4 , 其反应的化学方程式为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;冷却溶液时会降低NaHSO4的溶解度,使NaHSO4结晶析出;高氯酸的沸点低,易挥发,蒸馏可以得到纯净的高氯酸,(1)根据上述分析,操作①为过滤,所以答案是:过滤;(2)因为Ca(ClO)2、ClO2、NaClO、NaClO2等均具有强氧化性,常用作消毒剂和漂白剂,所以答案是:强氧化性;(3)反应器Ⅰ中投料时如果硫酸加少了会生成高氯酸钠,加入过量的硫酸是为了制得高氯酸,
所以答案是:为了产物能得到HClO4而不是NaClO4;(4)反应器Ⅱ中ClO2与二氧化硫、氢氧化钠反应生成亚氯酸钠,其反应的离子方程式为:4OH﹣+SO2+2ClO2=2ClO2﹣+SO42﹣+2H2O,
所以答案是:4OH﹣+SO2+2ClO2=2ClO2﹣+SO42﹣+2H2O;(5)水沸点是100℃,HClO4的沸点是130℃,最先蒸馏流出的是水而不是HClO4 , 有液体流出时立即收集得到的是谁,不能得到HClO4纯品,因此不合理,
所以答案是:不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4;

【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .