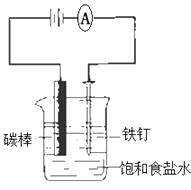
题目内容
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质. 
请回答:
(1)仪器E的名称是 . 若没有装置C,将气体直接排放到空气中,会带来的主要环境问题是 .
(2)观察到B中溶液颜色变浅,说明了SO2具有的性质是;
(3)写出仪器D中的实验现象 , 发生氧化还原反应的离子方程式 .
【答案】
(1)U形管;酸雨
(2)还原性
(3)溶液由黄色变浅绿色;2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
【解析】解:(1)由仪器图形可知E为U形管,二氧化硫可导致酸雨,所以答案是:U形管;酸雨;(2)B中二氧化硫和高锰酸钾溶液分数氧化还原反应,溶液颜色变浅,所以答案是:还原性;(3)D中铁离子与二氧化硫发生氧化还原反应,可观察到溶液由黄色变浅绿色,发生2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ ,
所以答案是:溶液由黄色变浅绿色;2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ .

【题目】向盛有H2O2的试管中滴入一定量浓盐酸,有刺激性气味的气体生成.经实验证明该气体只含有O2、Cl2、HCl和水蒸气.将气体通入X溶液(如下图),依据观察到的现象,能判断气体中含有Cl2的是( )
X溶液 | 现象 |
| |
A | 紫色石蕊溶液 | 溶液先变红后褪色 | |
B | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
C | 滴有KSCN的FeSO4溶液 | 溶液变为红色 | |
D | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 |
A.A
B.B
C.C
D.D
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面.
查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如图:
(1)操作①的名称是 .
(2)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有
(3)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的 .
(4)反应器Ⅱ中发生反应的离子方程式为 .
(5)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由 .