题目内容
【题目】现有下列九种物质:
①H2②铝 ③醋酸 ④CO2⑤H2SO4⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3 ⑩NaHSO4
(1)按物质的分类方法填写表格的空白处:
属于非电解质的是属于弱电解质的是
属于强电解质的是能导电的是
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑩在水中的电离方程式为 , 34.2g⑨溶于水配成250mL溶液,SO42﹣的物质的量浓度为 .
(4)少量的④通入⑥的溶液中反应的离子方程式为: .
(5)将⑩的溶液加入⑥的溶液中至溶液中的Ba2+离子恰好完全沉淀时反应的离子方程式 .
【答案】
(1)④,③,⑤⑥⑨⑩,②⑦⑧⑨
(2)Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)NaHSO4=Na++H++SO42﹣,1.2mol/L
(4)Ba2++2OH﹣+CO2=BaCO3↓+H2O
(5)Ba2++OH﹣+2H++SO42﹣=BaSO4↓+H2O
【解析】解:(1)①H2 不含自由电子或者自由移动的离子,不能导电;是单质,既不是电解质,也不是非电解质;
②铝含自由电子,能够导电;是单质,既不是电解质,也不是非电解质;
③醋酸不含自由电子或者自由移动的离子,不能导电;在水溶液里能部分电离出离子而导电的化合物,是电解质,属于弱电解质;
④CO2不含自由电子或者自由移动的离子,不能导电;本身不能电离,属于非电解质;
⑤H2SO4 不含自由电子或者自由移动的离子,不能导电;在水溶液里能全部电离出离子而导电的化合物,是电解质,属于强电解质;
⑥Ba(OH)2固体不含自由电子或者自由移动的离子,不能导电;在水溶液里或熔融状态下能全部电离出离子而导电的化合物,是电解质,属于强电解质;
⑦氨水含自由移动的离子,能导电;属于混合物,既不是电解质,也不是非电解质;
⑧稀硝酸 含自由移动的离子,能导电;属于混合物,既不是电解质,也不是非电解质;
⑨熔融Al2(SO4)3 含自由移动的离子,能导电;在水溶液里或熔融状态下能全部电离出离子而导电的化合物,是电解质,属于强电解质;
⑩NaHSO4不含自由电子或者自由移动的离子,不能导电;在水溶液里或熔融状态下能全部电离出离子而导电的化合物,是电解质,属于强电解质;
所以:属于非电解质的是:④;属于弱电解质的是;③;属于强电解质的是:⑤⑥⑨⑩;能导电的是:②⑦⑧⑨;
所以答案是:④;③;⑤⑥⑨⑩;②⑦⑧⑨;
(2)H++OH﹣═H2O表示强酸与强碱反应生成可溶性盐和水,可以表示硝酸与氢氧化钡的反应,化学方程式:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
所以答案是:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(3)硫酸氢钠为强电解质,完全电离,电离方程式:NaHSO4=Na++H++SO42﹣;
34.2g硫酸铝0.1mol,硫酸铝的物质的量浓度C= ![]() =0.4mol/L,硫酸铝为强电解质,完全电离,所以硫酸根离子浓度为硫酸铝浓度的3倍,所以硫酸根离子浓度为0.4mol/L×3=1.2mol/L;
=0.4mol/L,硫酸铝为强电解质,完全电离,所以硫酸根离子浓度为硫酸铝浓度的3倍,所以硫酸根离子浓度为0.4mol/L×3=1.2mol/L;
所以答案是:NaHSO4=Na++H++SO42﹣;1.2mol/L;
(4)少量二氧化碳与氢氧化钡反应生成碳酸钡沉淀和水,离子方程式:Ba2++2OH﹣+CO2=BaCO3↓+H2O;
所以答案是:Ba2++2OH﹣+CO2=BaCO3↓+H2O;
(5)硫酸氢钠与氢氧化钡1:1反应Ba2+离子恰好完全沉淀,离子方程式:Ba2++OH﹣+2H++SO42﹣=BaSO4↓+H2O,
所以答案是:Ba2++OH﹣+2H++SO42﹣=BaSO4↓+H2O.
【考点精析】利用强电解质和弱电解质的概念和判断对题目进行判断即可得到答案,需要熟知强电解质:离子键、强极性键、完全电离;弱电解质:极性键、部分电离.

【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面.
查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如图:
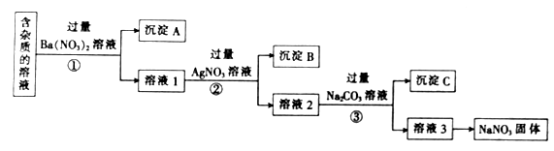
(1)操作①的名称是 .
(2)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有
(3)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的 .
(4)反应器Ⅱ中发生反应的离子方程式为 .
(5)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由 .