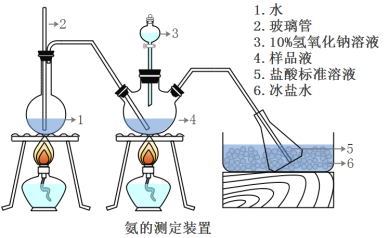
题目内容
【题目】开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1= -1275.6 kJ·mol-1,②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1,③H2O(g)=H2O(l) ΔH3= -44.0 kJ·mol-1,
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______________。
(2)工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJmol-1。
CH3OH(g) △H= -90.8kJmol-1。
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,以CH3OH表示该过程的反应速率v(CH3OH)=______。
②要提高反应2H2(g)+CO(g)CH3OH(g)中CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.加入惰性气体 f.分离出甲醇
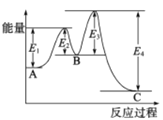
(3)如图是一个化学过程的示意图:

①图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式: ____________________________。
③乙池中总反应的离子方程式为______________________________________。
④当乙池中B(Ag)极的质量增加5.40g时,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.Al(NO3)3
【答案】CH3OH(1)+O2(g)=CO(g)+2H2O(1) △H= -442.8 kJmol-1 80% 0.08mol/(L·min) df 原电池 CH3OH CH3OH-6e-+8OH-=CO32-+6H2O 4Ag++2H2O![]() 4Ag+O2↑+4H+ B
4Ag+O2↑+4H+ B
【解析】
(1)甲醇不完全燃烧生成CO和液态水,其反应方程式为CH3OH+O2→CO+2H2O,根据盖斯定律,![]() ,推出CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=
,推出CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=![]() = -442.8kJ·mol-1;
= -442.8kJ·mol-1;
(2)①达到平衡时,n(CO)=0.2mol·L-1×2L=0.4mol,
2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
起始: 6 2 0
变化:3.2 1.6 1.6
平衡:2.8 0.4 1.6
CO的转化率为![]() ×100%=80%;根据化学反应速率的表达式,v(CH3OH)=
×100%=80%;根据化学反应速率的表达式,v(CH3OH)=![]() =0.08mol/(L·min);
=0.08mol/(L·min);
②a、该反应为放热反应,升温,平衡向逆反应方向移动,即CO转化率降低,故a不符合题意;
b、加入催化剂,使用催化剂,对化学平衡移动无影响,故b不符合题意;
c、增加CO的浓度,虽然平衡向正反应方向移动,但CO的转化率降低,故c不符合题意;
d、加入H2,平衡向正反应方向进行,CO的转化率增大,故d符合题意;
e、体积不变,加入惰性气体,组分浓度不变,化学平衡不移动,CO转化率不变,故e不符合题意;
f、分离出甲醇,减小生成物的浓度,平衡向正反应方向移动,CO的转化率增大,故f符合题意;
答案选df;
(3)①根据甲池的装置图,甲池装置图为原电池,通CH3OH一极为负极,通氧气的一极为正极,根据原电池工作原理,OH-向负极移动,即向通CH3OH一极移动;
②甲池是燃料电池,相当于CH3OH在氧气燃烧,电解质为KOH溶液,C元素最终以CO32-形式存在,负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;
③A电极接电池正极,A电极为阳极,电极反应式为2H2O-4e-=O2↑+4H+, B电极为阴极,电极反应式为Ag++e-=Ag,总反应离子方程式为4Ag++2H2O![]() 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
④乙池中B电极反应式为Ag++e-=Ag,B极增加5.40g,生成Ag的物质的量为![]() =0.05mol,电路中转移电子物质的量为0.05mol,丙池某电极上析出金属,该电极为阴极,即D电极,乙池和丙池为串联电路,丙池通过的电子物质的量也为0.05mol,
=0.05mol,电路中转移电子物质的量为0.05mol,丙池某电极上析出金属,该电极为阴极,即D电极,乙池和丙池为串联电路,丙池通过的电子物质的量也为0.05mol,
A、硫酸镁中Mg位于H元素的前面,即阴极上不析出金属,故A不符题意;
B、电解CuSO4溶液时,D电极反应式为Cu2++2e-=Cu,转移电子0.05mol,析出铜的质量为1.60g,故B符合题意;
C、电解NaCl水溶液,没有金属析出,故C不符合题意;
D、电解Al(NO3)3水溶液,没有金属析出,故D不符合题意;
答案选B。

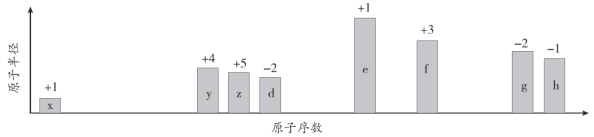
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)③、④、⑤、⑥简单离子半径由小到大的顺序为_____________________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

(a)X溶液与Y溶液反应的离子方程式为_________,
(b)N→⑥的单质的化学方程式为________________。