题目内容
【题目】氢能是理想的清洁能源,资源丰富。以太阳能为热源分解 Fe3O4 ,经由热化学铁氧化合物循环分解水制H2 的过程如下:
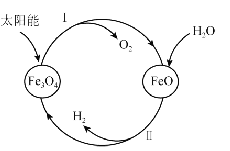
(1)过程Ⅰ:![]()
①将O2分离出去,目的是提高Fe3O4的 。
②平衡常数K 随温度变化的关系是 。
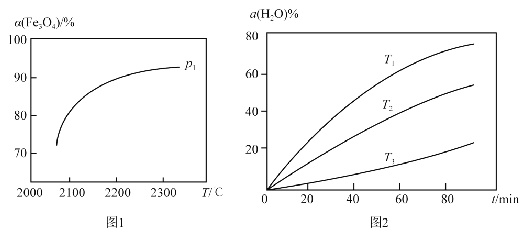
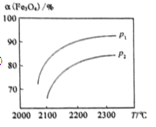
③在压强 p1下, Fe3O4的平衡转化率随温度变化的![]() (Fe3O4) ~ T 曲线如图 1 所示。若将压强由p1增大到p2 ,在图1 中画出 p2 的
(Fe3O4) ~ T 曲线如图 1 所示。若将压强由p1增大到p2 ,在图1 中画出 p2 的![]() (Fe3O4) ~ T 曲线示意图。
(Fe3O4) ~ T 曲线示意图。
(2)过程Ⅱ的化学方程式是 。
(3)其他条件不变时,过程Ⅱ在不同温度下, H2O的转化率随时间的变化![]() (H2 O) ~ t曲线如图2 所示。比较温度T1 、T2 、T3的大小关系是 ,判断依据是 。
(H2 O) ~ t曲线如图2 所示。比较温度T1 、T2 、T3的大小关系是 ,判断依据是 。
(4)科研人员研制出透氧膜(OTM) ,它允许电子、O2-同时透过,可实现水连续分解制H2。工作时,CO、H 2O分别在透氧膜的两侧反应。工作原理示意图如下:
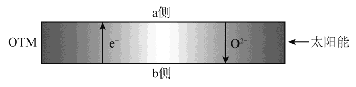
H2O在 侧反应(填“ a ”或“ b ”),在该侧H2O释放出H2的反应式是 。
【答案】(1)①转化率。②随着温度升高,平衡常数K变大。
③
(2)3FeO+H2O![]() Fe3O4+H2↑;
Fe3O4+H2↑;
(3)T 1>T2>T3;初始压强相同,浓度相同,图像斜率T 1>T2>T3,温度越高,反应速率越大,则说明T 1>T2>T3。(4)a;H2O + 2e-=H2+O2-。
【解析】
试题分析:(1)①过程I 的反应中,分理出O2可以可逆反应向正反应方向移动,提高Fe3O4的转化率。②该反应为吸热反应,温度升高,平衡正向移动,使化学平衡常数增大;③该反应的正反应是气体体积增大的反应,压强增大,平衡向气体系数减小的逆反应方向移动,物质的转化率降低。用图像表示为 ;
;
(2)过程Ⅱ的化学方程式是反应物为FeO 和H2O,生成物为Fe3O4和H2。根据原子守恒,完成配平方程式可得3FeO+H2O![]() Fe3O4+H2↑;。(3)可以从图像斜率看出速率大小。温度与速率呈现正相关。由于斜率T 1>T2>T3,斜率越大,反应速率越快,物质的转化率就越大,所以温度高低关系是T 1>T2>T3 。(4)本实验利用水制取氢气,H2O得电子生成H2和O2-,O2-通过OTM 进入b 侧,所以H2O在a 侧,反应方程为H2O + 2e-=H2+O2-。
Fe3O4+H2↑;。(3)可以从图像斜率看出速率大小。温度与速率呈现正相关。由于斜率T 1>T2>T3,斜率越大,反应速率越快,物质的转化率就越大,所以温度高低关系是T 1>T2>T3 。(4)本实验利用水制取氢气,H2O得电子生成H2和O2-,O2-通过OTM 进入b 侧,所以H2O在a 侧,反应方程为H2O + 2e-=H2+O2-。

 学习实践园地系列答案
学习实践园地系列答案【题目】如图所示,室温下,甲、乙两个容积相等的烧瓶中分别装满了两种气体(同温、同压)成份见下表,打开止水夹K,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是
编号 | ① | ② | ③ |
甲中气体 | H2 | NH3 | NO |
乙中气体 | Cl2 | HCl | O2 |

A. ②③① B. ③①② C. ③②① D. ①②③


