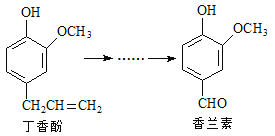
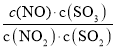题目内容
【题目】已知100℃时,0.01mol·L-1NaHSO4溶液中水电离的c(H+)=10-10mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1L与pH=5的NaHSO4溶液V2L混合,所得溶液pH=7,则V1:V2为( )
A.2:9B.9:2C.1:9D.1:2
【答案】A
【解析】
硫酸氢钠溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,0.01molL-1NaHSO4溶液中c(H+)=0.01mol/L,溶液中c(OH-)=水电离的c(H+)=10-10molL-1,所以该温度下Kw=10-12,中性溶液pH=6;
则该温度下pH=8的Ba(OH)2溶液中c(OH-)=10-4molL-1,pH=5的NaHSO4溶液中c(H+)=10-5molL-1,所得溶液pH=7>6,溶液呈碱性,所以碱过量,混合液中c(OH-)=![]() =
=![]() ,解得V1:V2=2:9,故选A。
,解得V1:V2=2:9,故选A。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的工艺流程如图所示,回答下列问题。
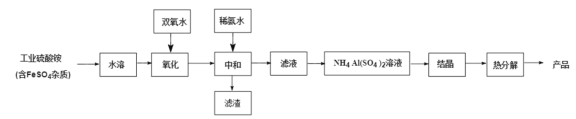
(1)“氧化”步骤发生的离子方程式为:________, 使用双氧水作氧化剂优点为:______________。
(2)“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为______________。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失
重计算值( 失重计算值(%)![]() )如表所示:
)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在______________温度区间铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是_____
(5)该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:______________。
(6)通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=______________(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38, lg5=0.7)。