题目内容
【题目】某化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
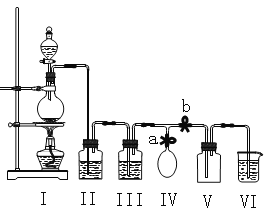
(1)写出Ⅰ装置烧瓶中发生的反应的离子方式: 。
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是 ;装置Ⅲ的作用是干燥氯气,应盛放___________。
(3)实验开始后,先 a b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,再 a b,换好集气瓶后,继续收集氯气
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的是(填序号) 。
A.氢氧化钠溶液 B.浓硫酸 C.水
(5)氯气是重要的化工原料,以乙烯、氯气、氢氧化钙和水等物质为原料制取环氧乙烷(C2H4O),教材中介绍经典的方法包括两部反应:
①CH2=CH2+Cl2+H2O→ClCH2CH2OH+HCl
②ClCH2CH2OH+HCl+Ca(OH)2→C2H4O+CaCl2+2H2O
根据以上两步,求生成环氧乙烷的原子利用率为 %。
【答案】
(1)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)除去Cl2中混有的HCl、浓硫酸;
(3)关闭、打开、打开、关闭;
(4)BC;(5)25.4;
【解析】
试题分析:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,离子方程式为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入烧瓶前,应该用饱和食盐水和浓硫酸分别除去氯化氢和水蒸气;故答案为:除去Cl2中混有的HCl、浓硫酸;
(3)实验开始后,先收集氯气,则关闭a,打开b;当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,多余的氯气用气囊来收集,则打开a,关闭b;故答案为:关闭、打开、打开、关闭;
(4)氯气能够与氢氧化钠溶液,在水中的溶解度不大,且溶解得氯气部分与水反应,氯气与稀硫酸不反应,所以其中不恰当的是浓硫酸和水;故选:BC;
(5)将①+②得CH2 = CH2+ Cl2+Ca(OH)2→G2H4O+ CaCl2+H2O,生成环氧乙烷的原子利用率为![]() ×100%=
×100%=![]() ×100%=25.4%,故答案为:25.4。
×100%=25.4%,故答案为:25.4。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案