题目内容
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
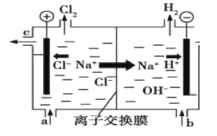
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为 : 、 。
(3)精制饱和食盐水从图中__________位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
(5)室温下,0.1mol/LNaClO溶液的pH 0.1 mol/LNa2SO3溶液的pH。(选填“大于”、“小于”或“等于”)
(6)浓度均为0.1mol/L的N2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为 。
(7)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
①联氨分子的电子式为 。
②实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
【答案】(1)2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(2)阻止OH-进入阳极室,与Cl2发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)a;d;
(4)2KClO3+ H2C2O4+ 2H2SO4= 2ClO2↑+2CO2↑+2KHSO4+2H2O
(5)大于;(6)c(SO32–)>c(CO32–)>c(HCO3–)>c(HSO3–)。
(7)①![]() ②2NH3+NaClO=N2H4+NaCl+H2O
②2NH3+NaClO=N2H4+NaCl+H2O
【解析】
试题分析:(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应。产生Cl2。反应的离子方程式是2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)图中的离子交换膜只允许阳离子通,是阳离子交换膜,可以允许阳离子通过,不能使阴离子通过,这样就可以阻止阴极溶液中的OH-进入阳极室,与氯气发生反应,阻止Cl-进入阴极室,使在阴极区产生的NaOH纯度更高。同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
(4)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+ H2C2O4+ 2H2SO4= 2ClO2↑+2CO2↑+2KHSO4+2H2O;
(5)NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性。形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的酸性强于HClO,因此溶液的pH: NaClO> Na2SO3。
(6)由于电离程度:H2SO3> H2CO3>HSO3->HCO3-,浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,水解程度:CO32–>SO32–,所以离子浓度:SO32–>CO32–;水解产生的离子浓度:HCO3- > HSO3-。但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。所以在该溶液中SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为c(SO32–)>c(CO32–)>c(HCO3–)>c(HSO3–)。
(7)①根据氨气的电子式可判断肼的电子式为![]() ;②次氯酸钠的还原产物是氯化钠,同时还有水生成,反应的方程式为2NH3+NaClO=N2H4+NaCl+H2O。
;②次氯酸钠的还原产物是氯化钠,同时还有水生成,反应的方程式为2NH3+NaClO=N2H4+NaCl+H2O。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案