题目内容
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比S强的实验研究。
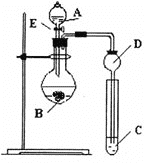
回答下列问题:
(1)图中D装置名称是________________。
(2)N、C、Si的非金属性由强到弱的顺序是:_____________;
从以下所给物质中选出甲同学设计的实验所用到物质: 试剂A为_________;试剂C为_________(填序号)。
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
写出试管中反应的离子方程式为_____________________________
(3)乙同学设计的实验所用到试剂A为________;试剂B为________;试剂C为________。
写出试管中反应的离子方程式为___________________________________
【答案】 长颈漏斗 N、C、Si ① ④ CO2+SiO32-+H2O=CO32-+H2SiO3↓ 浓盐酸 高锰酸钾固体 氢硫酸或硫化钠溶液 Cl2+S2-=S↓+2Cl-
【解析】(1)由装置图可知,A为加液装置,A为分液漏斗;故答案为:长颈漏斗;
(2)同周期从左到右非金属性增强,则C<N,同主族元素从上到下非金属性:C>Si,所以非金属性由强到弱的顺序是:N>C>Si;通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,所以A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液,反应的离子方程式为CO2+SiO32-+H2O=CO32-+H2SiO3↓,故答案为:N>C>Si;①;④;CO2+SiO32-+H2O=CO32-+H2SiO3↓;
(3)为了完成Cl元素的非金属性比S强的实验研究,可以通过比较单质的氧化性来判断非金属性,所以用浓盐酸与高锰酸钾反应生成氯气,氯气通过氢硫酸或硫化钠溶液会生成硫单质,反应的离子方程式为Cl2+S2-=S↓+2Cl-,故答案为:浓盐酸;高锰酸钾固体;氢硫酸或硫化钠溶液;Cl2+S2-=S↓+2Cl-。