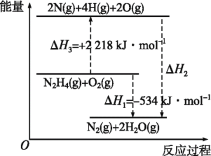
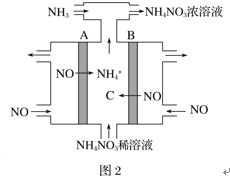
题目内容
【题目】常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。已知在点③处恰好中和。下列说法错误的是
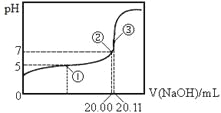
A.该温度下CH3COOH的电离平衡常数约为1.8 ×10-5
B.点①处溶液中c(CH3COO-)<c(CH3COOH)
C.点③处溶液中c(OH-)= c(CH3COOH)+c(H+)
D.滴定过程中不可能出现:c(CH3COOH) >c(CH3COO-)> c(OH-)> c(Na+)> c(H+)
【答案】B
【解析】
A、①点时,溶液为缓冲溶液,故可根据pka=pH+lg(c碱/c酸)计算,c(HAc)=![]() =0.1055mol/L,代入表达式可得到:pka=pH+lg(
=0.1055mol/L,代入表达式可得到:pka=pH+lg(![]() )="1.8" ×10-5,故A正确;
)="1.8" ×10-5,故A正确;
B、点①对应氢氧化钠的体积恰好是10mL,即乙酸和乙酸钠物质的量各占一半,但是由于乙酸的电离程度大于水解程度,故c(CH3COO-)<c(CH3COOH),错误;
C、③处恰好中和说明氢氧化钠与醋酸的物质的量相等,pH值大于7,是由于醋酸根离子水解生成OH-,水解部分很少,故根据物料守恒:c(Na+)=c(Ac-)+c(HAc),电荷守恒可得到:c(Na+)+c(H+)=c(Ac-)+c(OH-),整理可得到:c(OH-)= c(CH3COOH)+c(H+),故C正确;
D、滴定过程中,c(CH3COO-)> c(OH-)> c(Na+)> c(H+)都是阴离子大于阳离子,电荷不守恒,故D正确;
答案选B。

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目