题目内容
【题目】已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是( )
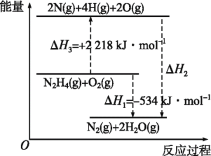
A.ΔH2=ΔH1+ΔH3
B.断裂1molO2(g)中的共价键需要吸收500kJ的能量
C.ΔH2>ΔH1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-534kJ·mol-1
【答案】B
【解析】
A.由图可知,ΔH2=ΔH1-ΔH3,故A错误;
B.N2H4(g)+O2(g)= 2N (g)+4H(g)+2O(g) ΔH=2218kJ·mol-1,由图可知,断裂1molN—N键需要154 kJ的能量、断裂1molN—H键需要391 kJ的能量、断裂1molH—O键需要463 kJ的能量,故断裂1molO2(g)中的共价键需要x kJ的能量,1mol肼的分子中含有1molN—N键和4molN—H键,反应物化学键断裂时吸收的总能量-形成化学键释放的总能量=焓变,154 kJ+391 kJ×4+x=2218kJ,解得x=500 kJ,故B正确;
C.由图可知,ΔH2=ΔH1-ΔH3=-534 kJ/mol- 2218 kJ/mol=-2752 kJ/mol,ΔH1=-534kJ·mol-1
ΔH2<ΔH1,故C错误;
D.根据图像可知,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1,由于气态水液化继续放热,N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-534kJ·mol-1,故D错误;
答案选B。

练习册系列答案
相关题目