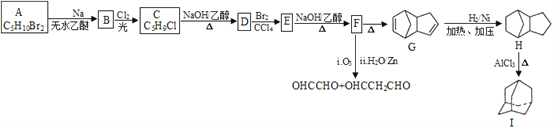
��Ŀ����
����Ŀ��һ�������£���ˮ��Һ��1 mol Cl����ClOx��(x��1��2��3��4)������(kJ)��Դ�С��ͼ��ʾ�������й�˵����ȷ����

A. a��b��c��d��e�У�c���ȶ�
B. b��a��c��Ӧ�Ļ��Ϊ��Ӧ������������������
C. b��a��d��Ӧ���Ȼ�ѧ����ʽΪ��3ClO��(aq)��ClO3��(aq)��2Cl��(aq)��H����116 kJ��mol��1
D. һ���¶��£�Cl2��NaOH��Һ��Ӧ���ɵIJ�����a��b��d����Һ��a��b��d��Ũ��֮�ȿ���Ϊ11��1��2
���𰸡�D
��������������Ԫ�صĻ��ϼۣ�a��b��c��d��e���δ���Cl-��ClO-��ClO2-��ClO3-��ClO4-��A���������Խ��Խ�ȶ�����ͼ�ɵ�a��b��c��d��e�У�a���ȶ���c��ȶ�����A����B���Ӧ������-����������=-��H������ͼ���������ж�b��a+c��Ӧ�Ļ�ܣ���B����C�aΪCl-��bΪClO-��dΪClO3-��B��A+D�Ļ�ѧ����ʽΪ3ClO-=ClO3-+2Cl-����������ṩ�����ݣ���Ӧ��Ϊ����H=64kJmol-1+2��0kJmol-1-3��60kJmol-1=-116kJmol-1����C������D�������ԭ��Ӧ��ѭ�����غ���Cl2��NaOH��Һ��Ӧ���ɵIJ�����a(Cl-)��b(ClO-)��d(ClO3-)����Ԫ�ػ��ϼ���0�۽�Ϊ-1�ۡ���Ϊ+1�ۺ�+5�ۣ��ɵ����غ�ã�n(Cl-)=n(ClO-)+5n(ClO3-)������Һ��a��b��d��Ũ��֮��Ϊ11��1��2ʱ���������غ�ʽ��������D��ȷ��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�