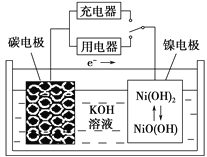
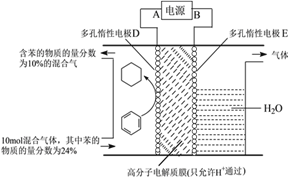
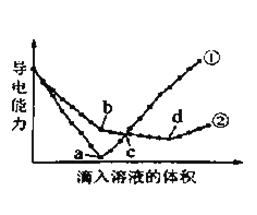
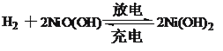题目内容
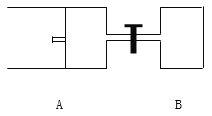
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。说法正确的是

A. a为CH4,b为CO2 B. CO![]() 向正极移动
向正极移动
C. 此电池在常温时也能工作 D. 正极电极反应式为O2+2CO2+4e-===2CO![]()
【答案】D
【解析】A.燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,左边电极是负极、右边电极是正极,所以a是CH4,b为O2,故A错误;B.原电池放电时,碳酸根离子向负极移动,故B错误;C.电解质为熔融碳酸盐,需要高温条件,故C错误;D.正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO32-,故D正确;故选D。

【题目】Fe、A1、Cu是生活中常用的金属。
(1)基态Cu原子核外电子排布式为_____________,基态Fe2+核外有_________个未成对电子。
(2)①re、Al、Cu三种元素第一电离能由高到低的顺序为___________________。
②Mn和Fe的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能/kJ mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是_____________。
(3)铁可形成多种配合物,如[Fe(CN)6]4-、Fe(CO)5等,lmol Fe(CN)43-中含有σ键的数目为________;Fe(CO)5熔点为-20.5℃,沸点为103℃:易溶于CCl4,据此可以判断Fe(CO)3晶体属于________ (填晶体类型)。
(4)下列变化过程中,破坏的力的作用类型相同的是_____________;(填字母代号)。
A.铝气化 B.A1C13溶于水 C.加热使铜熔化 D.熔融NaC1
(5)Fe能与N形成一种磁性材料,其晶胞结构如图所示:
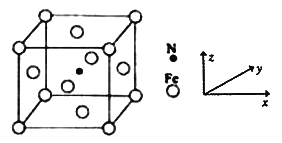
①该磁性材料的化学式为__________________;
②Fe原子的坐标参数为(![]() ,
, ![]() ,0)、(
,0)、(![]() ,0,
,0, ![]() )、________、(0,0,0),N原子的坐标参数为_______。
)、________、(0,0,0),N原子的坐标参数为_______。
③已知该晶体的晶胞参数α pm,列出其密度表达式为_________g cm-3(用含α的式子表示,只列式子,不作计算。)。