题目内容
下列表示对应化学反应的离子方程式正确的是( )
| A、用亚硫酸钠溶液处理纸浆中的残氯:SO32-+2OH-+Cl2═2Cl-+SO42-+H2O |
| B、二氧化硫通入足量的溴水中:SO2+Br2+2H2O═2HBr+2H++SO42- |
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O |
| D、向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氯气具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
B.溴化氢为强电解质,离子方程式中溴化氢应该拆开,写成离子形式;
C.氢氧化钠少量,氢离子优先与氢氧根离子反应,铵根离子不参与反应;
D.酸性高锰酸钾溶液中不存在大量的氢氧根离子,反应物应该为水,不能用氢氧根离子表示.
B.溴化氢为强电解质,离子方程式中溴化氢应该拆开,写成离子形式;
C.氢氧化钠少量,氢离子优先与氢氧根离子反应,铵根离子不参与反应;
D.酸性高锰酸钾溶液中不存在大量的氢氧根离子,反应物应该为水,不能用氢氧根离子表示.
解答:
解:A.用亚硫酸钠溶液处理纸浆中的残氯,氯气与亚硫酸钠溶液反应生成硫酸钠,反应的离子方程式为:SO32-+2OH-+Cl2═2Cl-+SO42-+H2O,故A正确;
B.二氧化硫通入足量的溴水中,二氧化硫被溴氧化成硫酸,溴化氢应该拆开,正确的离子方程式为:SO2+Br2+2H2O═2Br-+4H++SO42-,故B错误;
C.硫酸氢铵溶液中滴加少量NaOH溶液,硫酸氢铵电离的氢离子优先与氢氧根离子反应,铵根离子不反应,正确的离子方程式为:H++OH-═H2O,故C错误;
D.酸性KMnO4溶液中通入SO2,酸性溶液中,反应物中不能出现氢氧根离子,正确的离子方程式为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故D错误;
故选A.
B.二氧化硫通入足量的溴水中,二氧化硫被溴氧化成硫酸,溴化氢应该拆开,正确的离子方程式为:SO2+Br2+2H2O═2Br-+4H++SO42-,故B错误;
C.硫酸氢铵溶液中滴加少量NaOH溶液,硫酸氢铵电离的氢离子优先与氢氧根离子反应,铵根离子不反应,正确的离子方程式为:H++OH-═H2O,故C错误;
D.酸性KMnO4溶液中通入SO2,酸性溶液中,反应物中不能出现氢氧根离子,正确的离子方程式为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故D错误;
故选A.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;选项D为易错点,注意反应是在酸性条件下进行.

练习册系列答案
相关题目
下列各组离子在指定溶液中能大量共存的是( )
| A、无色溶液中:K+、Na+、MnO4-、SO42- |
| B、酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl- |
| C、加入Al能放出H2的溶液中:HCO3-、NO3-、Mg2+、Na+ |
| D、pH=11的溶液中:CO32-、Na+、AlO2-、NO3- |
25℃、101kPa下:①2Na(s)+
O2(g)═Na2O(s)△H1=-414kJ?mol-1②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ?mol-1,下列说法正确的是( )
| 1 |
| 2 |
| A、①和②产物的阴阳离子个数比不相等 |
| B、①和②生成等物质的量的产物,转移电子数不同 |
| C、25℃、101kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ?mol-1 |
| D、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
下列说法中错误的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、化学反应中的能量变化通常表现为热量变化 |
| D、已知Zn与稀硫酸的反应是放热反应,则1mol Zn与1mol H2SO4的总能量大于1mol ZnSO4与1mol H2的总能量 |
下列推断正确的是( )
| A、SiO2是酸性氧化物,不能与任何酸反应 |
| B、Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 |
| C、CO、NO都是大气污染气体,在空气中都能稳定存在 |
| D、将SO2通入Ba(ClO)2的溶液中,生成BaSO4沉淀 |
下列实验操作及结论正确的是( )
| A、使湿润的红色石蕊试纸褪色的气体一定是SO2 |
| B、量取8.58mL蒸馏水应选用10mL的量筒,而不能选用50mL的量筒 |
| C、检验氯代烃中含氯的方法是:向氯代烃中加入碱溶液,加热后先用稀硫酸酸化,再加入AgNO3溶液进行检验 |
| D、可用石墨作电极电解MgSO4和CuSO4的混合溶液,确定Mg和Cu的金属活动性强弱 |
下列实验操作正确的是( )
A、 检查气密性 |
B、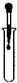 滴加试剂 |
C、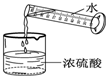 稀释浓硫酸 |
D、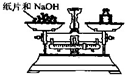 称量NaOH固体 |