题目内容
下列说法中错误的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、化学反应中的能量变化通常表现为热量变化 |
| D、已知Zn与稀硫酸的反应是放热反应,则1mol Zn与1mol H2SO4的总能量大于1mol ZnSO4与1mol H2的总能量 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量,与反应条件无关;
B.化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因;
C.化学反应往往伴随着能量的变化,能量的变化通常表现为热量的变化;
D.放热反应中反应物所具有的总能量高于生成物所具有的总能量;
B.化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因;
C.化学反应往往伴随着能量的变化,能量的变化通常表现为热量的变化;
D.放热反应中反应物所具有的总能量高于生成物所具有的总能量;
解答:
解:A.放热反应有的需加热,有的不需加热,如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,再如铝热反应也是,故A错误;
B.化学键的断裂和形成是化学反应中能量变化的主要原因,故B正确;
C.化学反应中的能量变化通常表现为热量变化,可以表现为光能、电能等,故C正确;
D.Zn与稀硫酸的反应是放热反应,反应物所具有的总能量高于生成物所具有的总能量,即1molZn与1mol H2SO4的总能量大于1mol ZnSO4与1mol H2的总能量,故D正确;
故选A.
B.化学键的断裂和形成是化学反应中能量变化的主要原因,故B正确;
C.化学反应中的能量变化通常表现为热量变化,可以表现为光能、电能等,故C正确;
D.Zn与稀硫酸的反应是放热反应,反应物所具有的总能量高于生成物所具有的总能量,即1molZn与1mol H2SO4的总能量大于1mol ZnSO4与1mol H2的总能量,故D正确;
故选A.
点评:本题考查了化学反应中的能量变化,题目难度不大,正确理解放、热吸热的本质是解题的关键.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、铁表面镀铜时,铜与电源的负极相连,铁与电源的正极相连 |
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| C、一定温度下,反应2Mg(s)+CO2(g)═2MgO(s)+C(s)能自发进行,则该反应△H<0 |
| D、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
常温下,下列溶液肯定呈酸性的是( )
| A、与金属铁反应放出氢气 |
| B、溶液中含有H+ |
| C、与金属铝反应放出氢气 |
| D、滴入酚酞试液后,溶液呈无色 |
下列表示对应化学反应的离子方程式正确的是( )
| A、用亚硫酸钠溶液处理纸浆中的残氯:SO32-+2OH-+Cl2═2Cl-+SO42-+H2O |
| B、二氧化硫通入足量的溴水中:SO2+Br2+2H2O═2HBr+2H++SO42- |
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O |
| D、向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
一定温度下,某一恒容密闭容器内有可逆反应:A(g)+3B(g)?2C(g),该反应进行到一定限度后达到化学平衡的标志是( )
| A、单位时间内生成a mol物质A,同时生成3a mol物质B |
| B、物质C的生成速率和分解速率相等 |
| C、容器内气体的密度不再随时间而改变 |
| D、物质A、B、C的分子数之比为1:3:2 |
下列实验操作不正确的是( )
| A、称量固体氯化钠药品时,将药品直接放在天平托盘上 |
| B、实验室用氯酸钾制氧气结束时先从水槽中移出导气管,再熄灭酒精灯 |
| C、用氯酸钾制氧气时,反应装置中的试管口应略向下倾斜 |
| D、用氢气还原氧化铜时,必须先验纯,且停止加热后,还要继续通入氢气直至冷却 |
下列关于有机物的叙述,不正确的是( )
| A、烃分子中,含有的氢原子个数一定是偶数 |
| B、用化学式C4H10表示的物质一定是纯净物 |
C、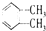 与 与 是同种物质,说明苯分子中碳碳键都相同 是同种物质,说明苯分子中碳碳键都相同 |
| D、某有机物完全燃烧只生成CO2和H2O,则该有机物不一定是烃 |
为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL 0.5mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应.下列实验操作能验证该反应是否存在限度的是( )
| A、再滴加AgNO3溶液,观察是否有黄色沉淀产生 |
| B、再加入CCl4振荡后,观察下层液体颜色是否变为紫红色 |
| C、再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察有否白色沉淀产生 |
| D、再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变血红色 |
 研究性学习小组进行溴乙烷的制备的相关探究实验.
研究性学习小组进行溴乙烷的制备的相关探究实验.