��Ŀ����
����Ŀ����ԭ�������ĵ���,���ֶ�����Ԫ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��������ͼ��ʾ��

�����жϳ���Ԫ�ػش����⣺
��1��A��B��Ϊ����ij����Ԫ����ɵķ��ӣ�A�����ĸ�ԭ�Ӻ˺�10�����ӣ�B����6��ԭ�Ӻ˺�18�����ӣ���A�ķ���ʽΪ________��B�ķ���ʽΪ_________��
��2���Ƚ�e��f���ӵİ뾶��С(��Ԫ�����ӷ��ű�ʾ)__________________���ǽ�����g_____h(����ǿ��������������)����һ����ѧ����ʽ֤��������� ________��
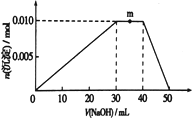
��3������Ԫ�ؿ������R����ѧʽΪzx4f(gd4)2��,��ʢ��10mL1mol��L1R��Һ���ձ��еμ�NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ��������ͼ��
������NaOH��Һ���ʵ�����Ũ��Ϊ_________________________��
��д��m�㷴Ӧ�����ӷ���ʽ______________________________��
������R��Һ�иļ�20mL1.1mol��L1Ba(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ______________mol.
���𰸡� NH3 N2H4 r(Na+)>r(Al3+) ���� H2S+Cl2===S��+2HCl 1molL1 NH4++OH-=NH3H2O 0.026.
����������x-h��Ϊ������Ԫ�أ�������״ͼ��֪��x���ڵ�һ���ڣ�y��z��d���ڵڶ����ڣ�e��f��g��h���ڵ������ڣ����ݸ�Ԫ��������ۻ�����ۿ�֪x��e������A�壬y���ڵ���A�壬z���ڵ���A�壬d��g���ڵ���A�壬f���ڵ���A�壬h���ڵ���A�壬�ɴ˿�֪xΪ�⡢yΪ̼��zΪ����dΪ����eΪ�ơ�fΪ����gΪ��hΪ�ȡ�
��1��A�����ĸ�ԭ�Ӻ˺�10�����ӣ�AΪNH3��B����6��ԭ�Ӻ˺�18�����ӣ�BΪN2H4����ȷ����NH3��N2H4��
��2��eΪ�ơ�fΪ������������Ų���ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽСr(Na+)>r(Al3+)��gΪ��hΪ����ͬһ����ԭ�Ӱ뾶ԽС���ǽ�����Խǿ������g����h�����������ⷴӦ�Ʊ����������������������Դ�������Ԫ�صķǽ����Դ�����Ԫ�أ���ӦΪH2S+Cl2==S��+2HCl����ȷ����r(Na+)>r(Al3+)��������H2S+Cl2==S��+2HCl��
��3��������Ԫ�ؿ������R��ѧʽΪNH4Al(SO4)2, ��ʢ��10mL1mol��L1R��Һ���ձ��еμ�NaOH��Һ,���������Ƶμӵ�50 mLʱ��ǡ���γ�ƫ�����ƺ�һˮ�ϰ������ݷ�Ӧ��ϵ��Al3+--4OH- ��NH4+-OH-��֪����NaOH��Һ���ʵ�����Ũ��Ϊcmol/L, c��50��10-3=10mL��1��10-3��4+10mL��1��10-3, c=1mol/L����ȷ����1molL1��
����ͼ��֪0-30mL��������ӦAl3++3OH-=Al(OH)3���������������������࣬m������м����������ƣ��������ʵ������䣬��NH4+��OH-��Ӧ����NH3H2O�����ӷ���ʽΪ��NH4++OH-=NH3H2O ��40-50mL��ʹ�����������ܽ⣻��ȷ�𰸣�NH4++OH-=NH3H2O��
��20mL1.1mol��L1Ba(OH)2��Һ�ṩ�����������ӵ���Ϊ20��1.1��10-3��2=0.044 mol��10mL��1mol��L1 NH4Al(SO4)2��Һ�к���NH4+����Ϊ10mL��1��10-3=0.01 mol������Al3+����Ϊ10mL��1��10-3=0.01 mol����������笠����ӷ�Ӧ���ĵ����������ӵ���Ϊ0.01 mol��ʣ������������ӵ���Ϊ0.044 -0.01=0.034 mol�����ݷ�Ӧ��ϵ��Al3+--3OH��Al(OH)3,��֪��0.01 mol Al3+��ȫ��Ӧ�������������ӵ���Ϊ0.03 mol��������������ϵ��֪��0.004 mol������������ȫ��Ӧ����������������Ϊ0.004 mol�����ղ�����������������Ϊ0.01-0.004 =0.006 mol������������������ӷ�Ӧ���ɳ������ᱵ���ݷ�Ӧ��ϵ��Ba2+---SO42_-BaSO4 ����������ӵ���Ϊ10mL��1��10-3��2=0.02mol�������ӵ���Ϊ20��1.1��10-3=0.022 mol��������������ӽ��м������������ᱵ����0.02mol������Һ�в������������ʵ���Ϊ0.02mol+0.006 mol=0.026 mol����ȷ����0.026��