题目内容
3.常温下,醋酸与氢氧化钠发生中和反应,当醋酸过量时,溶液的pH可能为( )| A. | pH<7 | B. | pH=7 | C. | pH>7 | D. | 都有可能 |
分析 醋酸与氢氧化钠发生中和反应时,当醋酸与氢氧化钠的物质的量相等时,二者恰好反应生成醋酸钠,溶液显示碱性;当醋酸稍过量时,若过量的醋酸电离出的氢离子的小于醋酸根离子水解生成的氢氧根离子的物质的量时,则溶液呈碱性;当过量的醋酸电离出的氢离子与醋酸根离子水解生成的氢氧根离子的物质的量相等时,溶液显示中性;当醋酸电离出的氢离子大于醋酸根离子水解生成的氢氧根离子的物质的量时,溶液显示酸性.
解答 解:常温下,醋酸与氢氧化钠发生中和反应,当醋酸过量时,混合液的酸碱性取决于醋酸电离出的氢离子与醋酸根离子水解生成的氢氧根离子的物质的量大小,
当过量的醋酸电离出的氢离子的物质的量小于醋酸根离子水解生成的氢氧根离子时,混合液呈碱性,则常温下溶液的pH>7;
当过量的醋酸电离出的氢离子与醋酸根离子水解生成的氢氧根离子的物质的量相等时,混合液显示中性,则常温下混合液的pH=7;
当过量的醋酸电离出的氢离子大于醋酸根离子水解生成的氢氧根离子的物质的量时,混合液显示酸性,则常温下混合液的pH<7,
根据分析可知,混合液的pH可能>7、=7或<7,
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确混合液酸碱性取决于醋酸电离出的氢离子与醋酸根离子水解生成的氢氧根离子的物质的量大小为解答关键,注意熟练掌握溶液酸碱性与溶液pH的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列各组中的物质属于同一类别(指酸、碱、盐、氧化物)的是( )
| A. | 烧碱、纯碱、熟石灰 | B. | 纯碱、胆矾、硫酸钠 | ||
| C. | 干冰、冰、金刚石 | D. | 氯化钙、氧化钙、硝酸钙 |
14.在恒容密闭容器中通入X、Y、Z发生反应:2X(g)?Y(g)+C(s),已知温度T1>T2,X的物质的量浓度c(X)随时间t变化曲线如图甲,速率变化如图乙,下列叙述不正确的是( )


| A. | 如图甲在T2线上,正反应速率:N点>W点 | |
| B. | 如图甲在T2下,在0~t1时间内的平均速率,v(X)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | 增加C的量,化学反应速率增大 | |
| D. | 如图乙,t0时可能是加入了催化剂 |
11.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液中:K+、Na+、Fe2+、SO42- | |
| B. | 在碱性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe3+溶液中:K+、Cl-、SO42-、Na+ |
18.下列反应属于取代反应的是( )
| A. | 甲烷与氯气反应生成四氯化碳 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 乙烯与氯化氢反应生成氯乙烷 | D. | 乙醇与酸性重铬酸钾溶液反应 |
8. 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:
请回答下列问题:
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
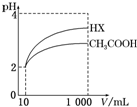
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
15.下列说法错误的是( )
①强电解质溶液的导电性比弱电解质溶液的导电性强
②BaSO4投入水中,导电性较弱,故它是弱电解质
③弱电解质水溶液中至少存在两种共价化合物分子
④强电解质都是离子化合物,弱电解质都是共价化合物
⑤CaO是强电解质,是因为它的水溶液能导电
⑥Cl2的水溶液能导电,所以Cl2是电解质.
①强电解质溶液的导电性比弱电解质溶液的导电性强
②BaSO4投入水中,导电性较弱,故它是弱电解质
③弱电解质水溶液中至少存在两种共价化合物分子
④强电解质都是离子化合物,弱电解质都是共价化合物
⑤CaO是强电解质,是因为它的水溶液能导电
⑥Cl2的水溶液能导电,所以Cl2是电解质.
| A. | ①②④⑤⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
12.下列关于试剂保存的说法错误的是( )
| A. | 氢氟酸不能存放于玻璃瓶中 | |
| B. | 氯水存放于棕色试剂瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 氢氧化钠溶液存放于玻璃塞的试剂瓶中 |
13.分析下表,下列选项中错误的是( )
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7, K2=5.6×l0-11 |
| A. | CH3COO-、CO32-、CN-在溶液中可以大量共存 | |
| B. | 向食醋中加入水可使CH3COOH的电离平衡向电离方向移动 | |
| C. | 相同物质的量浓度的Na2CO3和NaCN溶液,前者pH较大 | |
| D. | pH=a的上述3种酸溶液,加水后溶液的pH相同,则醋酸中加入的水最多 |