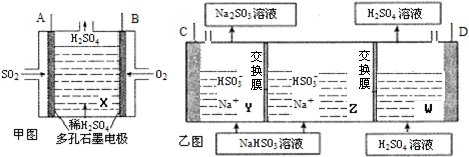
题目内容
15.下列说法错误的是( )①强电解质溶液的导电性比弱电解质溶液的导电性强
②BaSO4投入水中,导电性较弱,故它是弱电解质
③弱电解质水溶液中至少存在两种共价化合物分子
④强电解质都是离子化合物,弱电解质都是共价化合物
⑤CaO是强电解质,是因为它的水溶液能导电
⑥Cl2的水溶液能导电,所以Cl2是电解质.
| A. | ①②④⑤⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
分析 ①溶液导电性与离子浓度及离子所带电荷有关.离子浓度越大、离子所带电荷越多溶液导电能力越强;
②强、弱电解质的本质区别在于电解质是否完全电离;
③弱电解质的电离存在平衡,溶液中含有弱电解质分子、水分子两种共价化合物分子;
④强电解质不一定为离子化合物,弱电解质不一定是共价化合物;
⑤CaO与水反应生成氢氧化钙;
⑥电解质是指:在水溶液中或熔融状态下能够导电的化合物;电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;单质、混合物不是电解质.
解答 解:①溶液导电性与离子浓度及离子所带电荷有关.离子浓度越大、离子所带电荷越多溶液导电能力越强.如硫酸钡是强电解质,不溶于水,溶液几乎不导电,氢氧化钠是强电解质,如果溶液浓度很小,电子能力也不大,醋酸是弱电解质,溶液电子能力也可比氢氧化钠溶液导电能力强,故①错误;
②BaSO4投入水中,导电性较弱,是因为硫酸钡的溶解度小,离子浓度低,溶解的硫酸钡完全电离,硫酸钡是强电解质,强、弱电解质的本质区别在于电解质是否完全电离,故②错误;
③弱电解质的电离存在平衡,溶液中含有弱电解质分子、水分子两种共价化合物分子,故③正确;
④强电解质不一定为离子化合物,如HCl是共价化合物,但是强电解质,弱电解质不一定是共价化合物,如Al(OH)3是弱电解质,但是离子化合物,故④错误;
⑤CaO与水反应生成氢氧化钙,不是它本身电离,故⑤错误;
⑥氯气是金属单质,既不是电解质也不是非电解质,故⑥错误;
故选A.
点评 本题考查电解质与非电解质、强电解质与非电解质、弱电解质的电离等,难度不大,把握电解质的概念,强弱电解质的区别及电解质溶液的导电能力.

练习册系列答案
相关题目
5. 如图是某有机物分子的比例模型(填充模型),其中○代表氢原子,
如图是某有机物分子的比例模型(填充模型),其中○代表氢原子, 表示碳原子,
表示碳原子,
 代表氧原子.该有机物的名称是( )
代表氧原子.该有机物的名称是( )
 如图是某有机物分子的比例模型(填充模型),其中○代表氢原子,
如图是某有机物分子的比例模型(填充模型),其中○代表氢原子, 表示碳原子,
表示碳原子, 代表氧原子.该有机物的名称是( )
代表氧原子.该有机物的名称是( )| A. | 乙烷 | B. | 乙烯 | C. | 乙酸 | D. | 乙醇 |
6.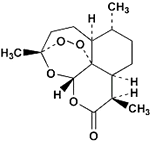 2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
 2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素不易溶于水,可溶于乙醚 | |
| C. | 青蒿素在一定条件下可发生水解、取代、加成、氧化反应 | |
| D. | 青蒿素分子内的一个过氧基团是对付疟原虫的核心基团 |
3.常温下,醋酸与氢氧化钠发生中和反应,当醋酸过量时,溶液的pH可能为( )
| A. | pH<7 | B. | pH=7 | C. | pH>7 | D. | 都有可能 |
20.向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO${\;}_{4}^{2-}$的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 反应结束时,可得到0.25 mol ZnSO4 | |
| C. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ | |
| D. | 最后生成的单质为Fe |
4.一定条件下存在反应:CO(g)+H2O(g)═CO2(g)+H2(g),△H<0.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1mol CO和1mol H2O,在II中充入1mol CO2 和1mol H2,在III中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A. | 容器I、II中正反应速率相同 | |
| B. | 容器I中CO 的物质的量比容器II中的多 | |
| C. | 容器I、III中反应的平衡常数相同 | |
| D. | 容器I中CO 的转化率与容器II中CO2 的转化率之和等于1 |
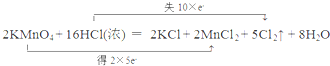 .
.