题目内容
11.下列各组离子在指定溶液中能大量共存的是( )| A. | 无色溶液中:K+、Na+、Fe2+、SO42- | |
| B. | 在碱性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe3+溶液中:K+、Cl-、SO42-、Na+ |
分析 A.亚铁离子为有色离子,不满足溶液无色的条件;
B.钡离子与磷酸根离子反应生成硫酸钡沉淀;
C.加入Al能放出H2的溶液为强碱性溶液或酸性溶液,碳酸氢根离子、铵根离子与氢氧根离子反应,碳酸氢根离子还与氢离子反应;
D.四种离子之间不反应,都不与铁离子反应.
解答 解:A.Fe2+为有色离子,不满足溶液无色的要求,故A错误;
B.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,HCO3-、NH4+与氢氧根离子反应,HCO3-与氢离子反应,在溶液中不能大量共存,故C错误;
D.K+、Cl-、SO42-、Na+之间不发生反应,且都不与Fe3+反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 绿色食品就是指颜色为绿色的食品 | B. | 白色污染是指白色的废弃物的污染 | ||
| C. | 食盐加碘是为了预防“大脖子”病 | D. | 有机食品是指含有有机物的食品 |
19.某溶液中大量存在以下浓度的五种离子:0.2mol/L Cl-、0.4mol/L SO${\;}_{4}^{2-}$、0.1mol/L Al3+、0.3mol/L H+、M,则M及物质的量浓度(mol/L)可能为( )
| A. | Na+0.3 | B. | Ba2+0.2 | C. | CO${\;}_{3}^{2-}$ 0.2 | D. | Zn2+0.2 |
6.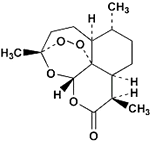 2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
 2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素不易溶于水,可溶于乙醚 | |
| C. | 青蒿素在一定条件下可发生水解、取代、加成、氧化反应 | |
| D. | 青蒿素分子内的一个过氧基团是对付疟原虫的核心基团 |
16.工业上常用热分解法冶炼的金属是( )
| A. | Al | B. | Fe | C. | Cu | D. | Ag |
3.常温下,醋酸与氢氧化钠发生中和反应,当醋酸过量时,溶液的pH可能为( )
| A. | pH<7 | B. | pH=7 | C. | pH>7 | D. | 都有可能 |
20.向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO${\;}_{4}^{2-}$的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 反应结束时,可得到0.25 mol ZnSO4 | |
| C. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ | |
| D. | 最后生成的单质为Fe |
1.单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是( )

| A. | S(s,单斜)=S(s,正交)△H=+0.33kJ/mol | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量 |