题目内容
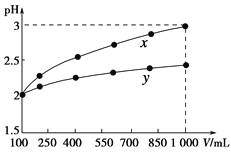
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。下列说法中错误的是( )

A.在该温度下,Zn(OH)2的溶度积(Ksp)为1×10-17
B.往1.0 L 1.0 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,没有Zn(OH)2沉淀生成
C.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
D.某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围为8.0~12.0
【答案】B
【解析】
A.Zn2+离子浓度为10-5molL-1时,Zn2+离子已沉淀完全,此时溶液的pH=8.0,c(Zn2+)=10-5 molL-1,c(OH-)=10-6 molL-1,Ksp=c(Zn2+)c2(OH-)=10-5(10-6)2=10-17,故A正确;
B.往1.0 L 1.0 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,此时Qc=c(Zn2+)c2(OH-)=1.0(10-8)2=10-16>Ksp,此时有Zn(OH)2沉淀生成,故B错误;
C.往ZnCl2溶液中加入足量的氢氧化钠溶液,开始Zn2+先沉淀为Zn(OH)2,后来Zn(OH)2溶解为[Zn(OH)4]2-,故离子方程式为Zn2++4OH-=[Zn(OH)4]2-,故C正确;
D.某废液中含Zn2+离子,为提取Zn2+离子可以将其转化为Zn(OH)2从而从废液中过滤出来,故应调节pH为8~12,故D正确;
故答案为B。

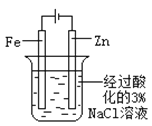
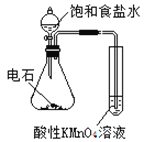
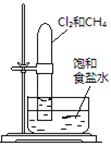
【题目】下述实验方案能达到实验目的的是 ( )
编号 | A | B | C | D |
实验 |
|
|
|
|
实验 | 验证铁钉发生 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 |
A.AB.BC.CD.D