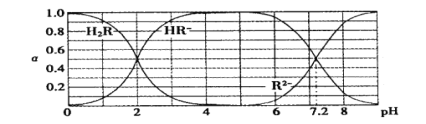
��Ŀ����
����Ŀ������ͼ��ʾװ���н��а��Ĵ�����ʵ�飺������ƿ�ڵ�Ũ��ˮ�в���ͨ������������ȵIJ�˿����ƿ�в��ӽ�Һ�档��Ӧ�����У��ɹ۲쵽ƿ���к���ɫ�����������˿ʼ�ձ��ֺ��ȡ������й�˵���������(����)

A. ��Ӧ����Һ�к���NO3-
B. ��Ӧ����Һ��c(H��)����
C. ʵ��������л��Ϸ�Ӧ����
D. ʵ�������NH3H2O�ĵ��볣�������ܷ����仯
���𰸡�D
��������A����Ӧ�����������ᣬ������������������ӣ�A��ȷ��B����Ӧ�������ᣬ������ǿ�ᣬ���Է�Ӧ����Һ��c��H+������pHֵ��С��B��ȷ��C.2NO+O2=2NO2��Ϊ���Ϸ�Ӧ��C��ȷ��D������������Ӧ���ȷ�Ӧ����Һ�¶����ߣ�ʵ�������NH3H2O�ĵ��볣���仯��D����ѡD��

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
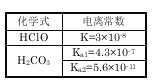
����������ϵ�д�����Ŀ���������ȣ�ClNO�����л��ϳ��е���Ҫ�Լ�����ҵ�Ͽ���NO��Cl2�ϳɣ��ش��������⣺
(1)һ�������£����������������ڴ����еĺ������������ʱ�������������ȣ��漰�Ȼ�ѧ����ʽ��ƽ�ⳣ�����±���
��� | �Ȼ�ѧ����ʽ | ƽ�ⳣ�� |
�� | 2NO2(g)+NaCl(s) | K1 |
�� | 4NO2(g)+2NaCl(s) | K2 |
�� | 2NO(g)+ Cl2(g) | K3 |
��H3=_________���æ�H1����H2��ʾ����K3=__________����K1��K2 ��ʾ��
(2)300��ʱ����һ�ܱ������з�����Ӧ��2ClNO(g) ![]() 2NO(g)+ Cl2(g)��������Ӧ���ʱ���ʽΪv��=k��cn(ClNO)��������ʺ�Ũ�ȵĹ�ϵ���±���
2NO(g)+ Cl2(g)��������Ӧ���ʱ���ʽΪv��=k��cn(ClNO)��������ʺ�Ũ�ȵĹ�ϵ���±���
��� | c(ClNO)/mol��L-1 | v��/mol��L-1��s-1 |
�� | 0.30 | 3.60��10-9 |
�� | 0.60 | 1.44��10-8 |
�� | 0.90 | 3.24��10-8 |
/p>
��n=________��k=___________���ﵽƽ�������Сѹǿ�����������ƽ����������_______�����������С�����䡱����
(3)25��ʱ�������Ϊ2L�Ҵ���ѹ�Ƶĺ����ܱ�������ͨ��0.08mol NO��0.04mol Cl2������Ӧ��2NO(g)+Cl2(g) ![]() 2ClNO(g) ��H
2ClNO(g) ��H
������Ӧ��ʼ��ƽ��ʱ�¶���ͬ����÷�Ӧ������ѹǿ��p����ʱ�䣨t���ı仯��ͼ������a��ʾ����H________0���>������<����ȷ��������������������ͬ�����ı�ijһ����ʱ�������ѹǿ��p����ʱ�䣨t���ı仯��ͼ������b��ʾ����ı��������___________��
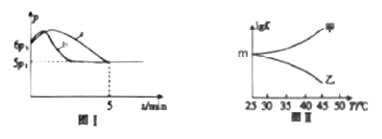
��ͼ���Ǽס���ͬѧ���������Ӧƽ�ⳣ���Ķ���ֵ��lgK�����¶ȵı仯��ϵ��������ȷ��������____����ס����ҡ�����mֵΪ_______________��