题目内容
【题目】某无色溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的几种。为确定成分,做如下实验:①取该溶液100mL,加入
中的几种。为确定成分,做如下实验:①取该溶液100mL,加入![]() 固体,产生无色气体
固体,产生无色气体![]() 标况
标况![]() 和白色沉淀,再加入
和白色沉淀,再加入![]() 溶液200mL后白色沉淀全部溶解;②在①所得溶液中加足量
溶液200mL后白色沉淀全部溶解;②在①所得溶液中加足量![]() 溶液,得到
溶液,得到![]() 不溶于盐酸的沉淀。由此可知原溶液中
不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在4种离子
B.![]() 一定存在,且
一定存在,且![]()
C.![]() 、
、![]() 一定存在,
一定存在,![]() 可能不存在
可能不存在
D.![]() 、
、![]() 一定不存在,
一定不存在,![]() 可能存在
可能存在
【答案】A
【解析】
无色溶液中一定不存在有色的![]() 和
和![]() ;
;![]() 取该溶液100mL,加入
取该溶液100mL,加入![]() 固体,物质的量为:
固体,物质的量为:![]() ,
,![]() 过氧化钠先与水反应生成
过氧化钠先与水反应生成![]() 氢氧化钠和
氢氧化钠和![]() 氧气,故产生的
氧气,故产生的![]() 无色气体中含有
无色气体中含有![]() 氧气,另外的
氧气,另外的![]() 为
为![]() ,溶液中一定含
,溶液中一定含![]() ,且物质的量为
,且物质的量为![]() ;此时白色沉淀出现,再加入
;此时白色沉淀出现,再加入![]() 溶液200mL即
溶液200mL即![]() 后白色沉淀全部溶解,则沉淀是氢氧化铝,即原溶液中一定含有
后白色沉淀全部溶解,则沉淀是氢氧化铝,即原溶液中一定含有![]() ,则一定不存在
,则一定不存在![]() ,由于
,由于![]() 铵根离子消耗
铵根离子消耗![]() 溶液,故将
溶液,故将![]() 转化为
转化为![]() 共消耗NaOH的物质的量为
共消耗NaOH的物质的量为![]() ,根据
,根据![]() 可知,
可知,![]() 的物质的量为:
的物质的量为:![]() ,则溶液中一定含有
,则溶液中一定含有![]() 、
、![]() ;一定不存在
;一定不存在![]() ;
;![]() 在
在![]() 所得溶液中加足量
所得溶液中加足量![]() 溶液,得到
溶液,得到![]() 不溶于盐酸的沉淀,则沉淀为
不溶于盐酸的沉淀,则沉淀为![]() ,物质的量为
,物质的量为![]() ,则原溶液中一定含有
,则原溶液中一定含有![]() ,且物质的量为
,且物质的量为![]() ,根据电中性原理,一定含有
,根据电中性原理,一定含有![]() ;所以溶液中一定含有
;所以溶液中一定含有![]() 、
、![]() 、
、![]() 、
、![]() ,一定不含
,一定不含![]() 、
、![]() 、
、![]() ,可能含有
,可能含有![]() ;
;
A. 溶液中至少存在4种离子,故A正确;
B. 根据电中性原理,一定含有![]() ,且
,且![]() ,故B错误;
,故B错误;
C. 溶液中一定含有![]() 、
、![]() 、
、![]() 、
、![]() ,一定不含
,一定不含![]() 、
、![]() 、
、![]() ,故C错误;
,故C错误;
D. 溶液中一定含有![]() 、
、![]() 、
、![]() 、
、![]() ,一定不含
,一定不含![]() 、
、![]() 、
、![]() ,可能含有
,可能含有![]() ,故D错误;
,故D错误;
故答案选A。

【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究。已知:碱式碳酸钴受热时可分解生成三种氧化物。
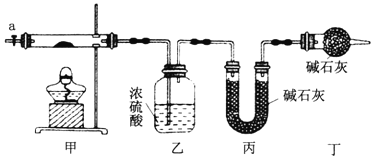
(1)按如图所示装置组装好仪器,并___________;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中_______(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是__________。
(2)某同学认为上述实验中存在一个缺陷,该缺陷是_________。
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为__________。
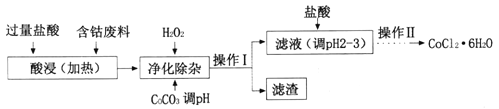
(4)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取COCl2·6H2O的一种工艺如下:
已知:25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为______________;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为_________;
③加盐酸调整pH为2~3的目的为___________;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。




