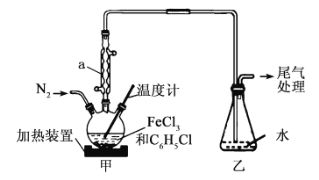
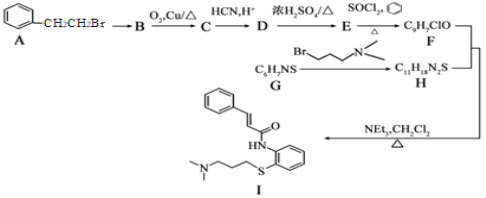
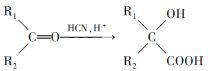
题目内容
【题目】下列解释事实的离子方程式正确的是( )
A.用过量氨水除去烟气中的二氧化硫:SO2+NH3·H2O=![]() +
+![]()
B.过量的Fe和稀硝酸反应:Fe+4H++![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
C.稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
D.实验室用MnO2和浓盐酸制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【答案】D
【解析】
A.用过量氨水除去烟气中的二氧化硫反应生成亚硫酸铵,反应的离子方程式为SO2+2NH3·H2O=2![]() +
+![]() +H2O,A错误;
+H2O,A错误;
B.过量的铁和稀硝酸反应生成亚铁离子和一氧化氮,反应的离子方程式为3Fe+8H++2![]() =3Fe2++2NO↑+4H2O,B错误;
=3Fe2++2NO↑+4H2O,B错误;
C.稀硫酸和氢氧化钡反应生成水和硫酸钡,水为弱电解质在书写离子方程式时不拆开,反应的离子方程式为Ba2++2OH-+2H++![]() =BaSO4↓+2H2O,C错误;
=BaSO4↓+2H2O,C错误;
D.实验室制取氯气,通过二氧化锰与浓盐酸混合加热的方法制取,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,D正确;
Mn2++Cl2↑+2H2O,D正确;
故选D。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
【题目】请同学们仔细阅读下表,并回答下列问题:
元素 | 甲 | 乙 | 丙 |
元素符号 | ① | Cl | O |
原子结构示意图 |
| ② | ③ |
周期 | 三 | ④ | 二 |
族 | ⑤ | ⅦA | ⅥA |
(1)写出①的元素符号___,②的原子结构示意图___,④的周期___,⑤的族___;
(2)甲元素最高价氧化物对应的水化物呈___性(填“酸”或“碱”),乙元素最高价氧化物对应的水化物的化学式为___,甲元素最高价氧化物对应的水化物与乙元素最高价氧化物对应的水化物相互反应的化学方程式为___;
(3)甲与乙两元素的单质反应生成物的电子式为___。