题目内容
NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A、1mol Na2O和Na2O2的混合物中所含阴离子数为NA |
| B、1.7g H2O2中含有的电子数为0.9NA |
| C、1mol Na2O2与足量的CO2反应,电子转移数为2NA |
| D、标准状况下,2.24L CO2和CO中所含分子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氧化钠是钠离子和氧离子构成、过氧化钠是钠离子和过氧根离子构成;
B、依据n
计算物质的量,结合分子式计算电子数;
C、依据过氧化钠和足量二氧化碳反应的化学方程式中 元素化合价变化分析判断电子转移;
D、依据标准状况气体物质的量n=
计算物质的量得到分子数.
B、依据n
| m |
| M |
C、依据过氧化钠和足量二氧化碳反应的化学方程式中 元素化合价变化分析判断电子转移;
D、依据标准状况气体物质的量n=
| V |
| 22.4 |
解答:
解:A、氧化钠是钠离子和氧离子构成、过氧化钠是钠离子和过氧根离子构成,1mol Na2O和Na2O2的混合物中所含阴离子数为NA,故A正确;
B、计算物质的量=
=0.05mol,结合分子式计算电子数=0.05mol×(2+2×8)×NA=0.9NA,故B正确;
C、过氧化钠和足量二氧化碳反应的化学方程式中 元素化合价变化分析判断电子转移,1mol Na2O2与足量的CO2反应,电子转移数为NA,故C错误;
D、标准状况气体物质的量n=
=
=0.1mol,0.1molCO2和CO中所含分子数为0.1NA,故D正确;
故选C.
B、计算物质的量=
| 1.7g |
| 34g/mol |
C、过氧化钠和足量二氧化碳反应的化学方程式中 元素化合价变化分析判断电子转移,1mol Na2O2与足量的CO2反应,电子转移数为NA,故C错误;
D、标准状况气体物质的量n=
| V |
| 22.4 |
| 2.24L |
| 22.4L/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移计算,物质结构分析判断,气体摩尔体积的条件应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A、苏打-NaHCO3 |
| B、胆矾-CuSO4 |
| C、酒精-CH3OH |
| D、生石灰-CaO |
某溶液由Mg2+、Al3+、Cl-、SO42-四种离子组成,测得其中Al3+的物质量浓度为0.3mol/L,SO42-的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为0.3mol/L,则溶液中Mg2+的物质的量浓度为( )
| A、0.2mol/L |
| B、0.1mol/L |
| C、0.05mol/L |
| D、0.4mol/L |
关于3Cl2+6KOH═KClO3+5KCl+3H2O的反应,以下说法正确的是( )
| A、Cl2是氧化剂,KOH是还原剂 |
| B、被还原的氯元素的质量是被氧化的氯元素质量的5倍 |
| C、若反应中消耗12mol KOH,则转移10mol电子 |
| D、将KClO3和KCl的混合物加入到硫酸中反应,不可能产生Cl2 |
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
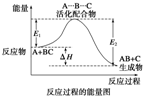

A、反应过程可表示为
| ||||||
| B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | ||||||
| C、正反应的热效应为△H=E1-E2<0,所以正反应为放热反应 | ||||||
| D、此图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 |
中学化学中很多“规律”,可经常用类推的思维方法去学习,结合你的所学下列几种类推结论中合理的是( )
| A、二氧化硫使品红褪色是因为其漂白性,二氧化硫使酸性高锰酸钾褪色也是因为其漂白性 |
| B、CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
| C、Fe与Cl2反应产生FeCl3,与硫单质反应产生Fe2S3 |
| D、H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO |