题目内容
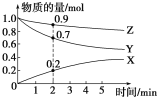
【题目】已知:还原性HSO3>I,氧化性IO3> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
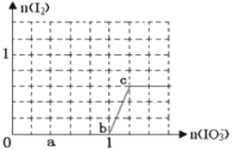
A. 0--b :3HSO3-+ IO3-= 3SO42-+ I-+ 3H+
B. a点时消耗NaHSO3的物质的量为1.2 mol
C. b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
D. 当溶液中I与I2的物质的量之比为5∶2时,加入的KIO3为1.8mol
【答案】D
【解析】
试题根据图像可知,o-b阶段没有单质碘生成,因此反应的离子方程式是3HSO3-+ IO3-= 3SO42-+ I-+ 3H+,A正确;亚硫酸氢钠总计是3mol,所以d点对应的亚硫酸氢钠是3mol÷5×2=1.2mol,B正确;根据氧化性可知,IO3-能氧化I-生成单质碘,所以选项C正确;b点碘酸钾的物质的量是1mol,生成碘离子也是1mol。根据反应式IO3-+5I-+6H+=3I2+3H2O可知,如果设此时消耗碘离子的物质的量是x,则消耗碘酸钾就是x/5,生成单质碘是3x/5,所以有(1-x)︰3x/5=5∶2,解得x=0.4,所以加入的的碘酸钾是1+x/5=1.08mol,选项D不正确,答案选D。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目