��Ŀ����
����Ŀ����0.4mol X�����0.6mol Y��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X��g��+5Y��g���TnZ��g��+6W��g����2minʱ����0.3mol W����ʱ��֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05molL��1min��1��
�Լ��㣺
��1��ǰ2min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ���٣�____
��2������nֵ��2minĩʱY��Ũ�ȣ�д����Ҫ�ļ�����̣���______
��3�������½�n���pH=10��m���pH=13����NaOH��Һ��ϵ�pH=12��NaOH��Һ����n��m=________
���𰸡�0.05molL-1min-1 4��0.175molL-1 100��11
��������
���⿼����ǻ�ѧ��Ӧ���ʡ�
��1���ͣ�2������![]() ������ʽ���н��
������ʽ���н��
��3����С���ǹ������ֲ���Ӧ����Һ��Ϻ���ҺpHֵ�ļ��㣬���ݻ��ǰ������(NaOH)���غ㣬��ʽ��⡣�йػ����Һ��pH���㣬����������ǧ������������˼ά����������ĸ������֣�����������ֻ�����֣���1����Ϻ�Ӧ����2����Ϻ�Ӧ��������Һ��ϡ�ͣ��ɽ�ˮ��ΪŨ��Ϊ0����Һ��������Ϻ�Ӧһ�࣬��һ������Һ��pHӦ����������Һ��pH֮�䣬����ᡢ����Һ���ۼӶ���ˮϡ�ͣ�������pH�������ܵ��ڴ�ˮ��pH�������²�����Ϊ7���������ҺpH�ļ��㷽��Ҳ�ܼ����跨��������Һ��C(H + )��������Һ�Լ��ԣ�������������Һ��c(OH �� )��Ȼ���ٻ���Ϊc(H + )��OH �� ���غ���ʽ��⡣
��1���仯��֮�ȵ��ڻ�ѧ������֮�ȣ���W�ı仯�����������X��Ũ�ȱ仯����0.2mol��2L��0.1mol/L����ǰ2 min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.1mol/L��2min��0.05mol��L��1��min��1����С���Ϊ��0.05mol��L��1��min��1��
��2����c(Z)=0.05n mol/2L =0.025n mol��L��1
v(Z)=��c/��t=0.025n mol��L��1��2min =0.05mol��L��1��min-1
���n=4
2minĩʱY��Ũ��Ϊ=0.35mol/2L=0.175 mol��L��1
��3��pH=10 ʱ�� c(H + )=10 -10 mol/L c(OH �� ) =10 -4 mol/L
pH=13 ʱ�� C(H + )=10 -13 mol/L c(OH �� ) =10 -1 mol/L
pH=12ʱ�� c(H + )=10 -12 mol/L c(OH �� ) =10 -2 mol/L
10 -4 ��n + 10 -1 ��m = (n+m) ��10 -2
n ��m = 100 ��11����С���Ϊ��100��11

����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã�����ѧ�����ش��������⣺
�� ���� | IA | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
(1)ԭ�Ӱ뾶��С��Ԫ����____����Ԫ�����ƣ���д�����ԭ�ӽṹʾ��ͼ______��
(2)����������Ӧ��ˮ�����У�������ǿ����___���û�ѧʽ�ش���ͬ����������ǿ����___��
(3)������γɵĻ������У���ѧ������Ϊ_____��
(4)������γɵĻ�����ĵ���ʽΪ___��������γɵ�ԭ�Ӹ�����Ϊ1:2�Ļ�����ĽṹʽΪ____��
(5)�ۡ��ܡ���ԭ�Ӱ뾶�ɴ�С��˳��Ϊ_____����Ԫ�ط��Żش𣩡�
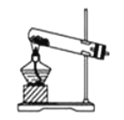
(6)Ϊ̽��Ԫ�آں͢�ķǽ�����ǿ����ijͬѧ�������ͼ��ʾ��װ�ý���ʵ�飨�г���������ȥ��װ�����������ã�����ش�

a.��ҺB��������_______
b.������____������֤������_______���û�ѧʽ�ش𣩣���ǽ�����_______����Ԫ�ط��Żش𣩡�
c.����ʵ���У���˵���ں͢�ǽ�����ǿ���Ļ�ѧ����ʽ��_____________��