题目内容
【题目】氮的化合物在生产和生活中广泛存在。请回答下列有关问题:
(1)氯胺(NH2Cl)是一种长效缓释消毒剂,可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)
△H=+12kJ·mol-1来制取。
![]()
己知部分化学键的键能如上表所示(假定不同物质中同种化学键的键能一样),则a=______。
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
(b)N2O2(g)+ O2(g)=2N02(g) (慢) Vb正=Kb正c2(N2O2)·c2(O2),Vb逆=Kb逆c2(NO2),△H2<0
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,其平衡常数K=______(用ka正、Ka逆、Kb正、Kb逆表示)。
2NO2(g)达到平衡状态,其平衡常数K=______(用ka正、Ka逆、Kb正、Kb逆表示)。
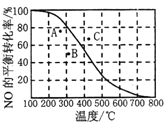
②100KPa时,密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则__点对应的压强最大,原因是______________。
2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则__点对应的压强最大,原因是______________。
③反应2NO(g)+O2(g)![]() 2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)
2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mo1,则此反应对NO的转化率的影响是____(填“增大”、“减小”或“无法判断”)。
2NO(g) △H=+180kJ/mo1,则此反应对NO的转化率的影响是____(填“增大”、“减小”或“无法判断”)。
④某温度下,反应2NO(g)+O2(g)![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将_____(填“正反应方向”、“逆反应方向”或“不”)称动。判断的依据是_____。 (3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置的阳极是_____(填“电极a”、“电极b”)。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将_____(填“正反应方向”、“逆反应方向”或“不”)称动。判断的依据是_____。 (3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置的阳极是_____(填“电极a”、“电极b”)。
②电解过程总反应的化学方程式为___________。
③若维持电流强度为6A,电解5小时,理论上可制祠NH4NO3的最大质量为_____g。(已知F=96500C/mol,保留小数点后l位)。
【答案】 a=191 ![]() C 由于该反应正反应是一个分子数减小的反应,A、B两点NO的转化率都低于100kPa时的转化率,故A、B两点的压强都低于100kPa,C点NO的转化率高于100kPa时的转化率,故C点的压强大于100kPa 无法判断 不 保证c(O2)不变情况下,增大容器体积,c(NO2)与c(NO)同等倍数减小,其浓度商不变,所以平衡不移动。 电极b 8NO+7H2O
C 由于该反应正反应是一个分子数减小的反应,A、B两点NO的转化率都低于100kPa时的转化率,故A、B两点的压强都低于100kPa,C点NO的转化率高于100kPa时的转化率,故C点的压强大于100kPa 无法判断 不 保证c(O2)不变情况下,增大容器体积,c(NO2)与c(NO)同等倍数减小,其浓度商不变,所以平衡不移动。 电极b 8NO+7H2O![]() 3NH4NO3+2HNO3 29.8
3NH4NO3+2HNO3 29.8
【解析】(1)焓变等于反应物键能之和与生成物键能之和的差值,则3×391+243-431-2×391-a=12,解得a=191;(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
(b)N2O2(g)+ O2(g)=2N02(g) (慢) Vb正=Kb正c2(N2O2)·c2(O2),Vb逆=Kb逆c2(NO2),△H2<0
①根据盖斯定律(a)+(b)即得到反应2NO(g)+O2(g)![]() 2NO2(g),因此达到平衡状态,其平衡常数K=
2NO2(g),因此达到平衡状态,其平衡常数K=![]() 。②由于该反应正反应是一个分子数减小的反应,A、B两点NO的转化率都低于100kPa时的转化率,故A、B两点的压强都低于100kPa,C点NO的转化率高于100kPa时的转化率,故C点的压强大于100kPa,因此C点压强最大。③反应2NO(g)+O2(g)
。②由于该反应正反应是一个分子数减小的反应,A、B两点NO的转化率都低于100kPa时的转化率,故A、B两点的压强都低于100kPa,C点NO的转化率高于100kPa时的转化率,故C点的压强大于100kPa,因此C点压强最大。③反应2NO(g)+O2(g)![]() 2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)
2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mo1是吸热反应,导致我的降低,但同时氧气浓度降低,NO浓度增大,因此无法判断NO的转化率。④某温度下,反应2NO(g)+O2(g)
2NO(g) △H=+180kJ/mo1是吸热反应,导致我的降低,但同时氧气浓度降低,NO浓度增大,因此无法判断NO的转化率。④某温度下,反应2NO(g)+O2(g)![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积,NO和NO2的浓度瞬间变小,且减小的程度一样,因此浓度熵等于平衡常数,则平衡不移动。(3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置中a电极是NO得到电子转化为铵根,a电极是阴极,所以b电极是阳极。②阳极是NO得到电子转化为硝酸根,所以电解过程总反应的化学方程式为8NO+7H2O
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积,NO和NO2的浓度瞬间变小,且减小的程度一样,因此浓度熵等于平衡常数,则平衡不移动。(3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置中a电极是NO得到电子转化为铵根,a电极是阴极,所以b电极是阳极。②阳极是NO得到电子转化为硝酸根,所以电解过程总反应的化学方程式为8NO+7H2O![]() 3NH4NO3+2HNO3。③由于持续通入氨气,所以根据方程式可知转移15mol电子,生成5mol硝酸铵。若维持电流强度为6A,电解5小时,则通过的电子的物质的量是
3NH4NO3+2HNO3。③由于持续通入氨气,所以根据方程式可知转移15mol电子,生成5mol硝酸铵。若维持电流强度为6A,电解5小时,则通过的电子的物质的量是![]() ,所以理论上可制得NH4NO3的最大质量为1.12mol/4×80g/mol=29.8g。
,所以理论上可制得NH4NO3的最大质量为1.12mol/4×80g/mol=29.8g。

【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)