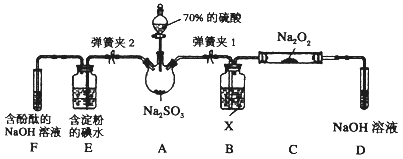
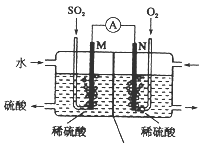
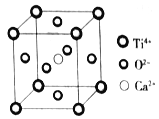
题目内容
【题目】下列有关晶体的说法中错误的是
A. 晶体中只要有阴离子就一定有阳离子
B. 原子晶体中共价键越强,熔点越高
C. 晶体中分子间作用力越大,分子越稳定
D. 晶体中不一定存在化学键
【答案】C
【解析】A.晶体中只要有阴离子就一定是离子晶体,所以一定有阳离子,所以A正确;B.原子晶体的结构粒子是原子,相邻的原子之间形成共价键,所以共价键越强,晶体的熔点就越高,B正确;C.晶体中分子间作用力越大,其熔点、沸点就越高,分子的稳定性是由分子内的共价键决定的,与分子间作用力无关,所以C不正确;D.稀有气体形成的分子晶体中没有化学键,因为稀有气体都是单原子分子,D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目