题目内容
下列有关溶液中离子浓度的关系,不正确的是
| A.NaHCO3溶液中存在:c(OH-)=c(H2CO3)+c(H+) |
| B.常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-) |
| C.0.2 mol/LNH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后,溶液中:c(NH4+)>c(Na+) |
| D.0.2 mol/L 的 CH3COOH 溶液中c(H+)小于0.1 mol/L 的 CH3COOH 中c(H+)的两倍 |
A
试题分析:A、根据电荷守恒和物料守恒可知,c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+)、c(HCO3-)+c(CO32-)+c(H2CO3)=c(Na+),所以c(CO32-)+c(OH-)=c(H2CO3)+c(H+),A不正确;B、氨水是弱碱,则pH=ll的氨水溶液的浓度大于0.001mol/L,则常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,氨水过量,溶液显碱性。则根据电荷守恒可知c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以溶液中c(NH4+)>c(Cl-),B正确;C、0.2 mol/LNH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后生成一水合氨、氯化钠,氯化铵过量,且过量的氯化铵与生成的一水合氨的浓度相同。由于氨水的电离程度大于NH4+的水解程度,所以溶液中:c(NH4+)>c(Na+),C正确;D、醋酸是弱酸,存在电离平衡。稀释有利于电离,所以0.2 mol/L 的 CH3COOH 溶液的电离程度小于0.1 mol/L 的 CH3COOH溶液的电离程度,因此溶液中前者c(H+)小于后者c(H+)的两倍,D正确,答案选A。

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
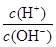 =1×1014的溶液:Ba2+、Na+、SO32-、NO3-
=1×1014的溶液:Ba2+、Na+、SO32-、NO3-