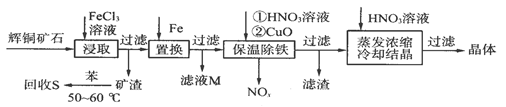
题目内容
下列实验正确的是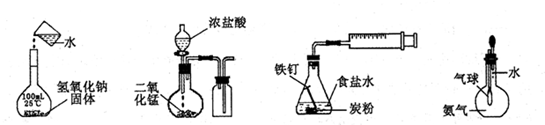
| A.配制一定浓度溶液 | B.制取并收集Cl2 | C.铁的析氢腐蚀 | D.验证氨气易溶于水 |
D
解析试题分析:氢氧化钠固体不能直接倒入100mL容量瓶中溶解,应先在烧杯中溶解、冷却至25℃时,才能移入容量瓶中,且移液时一定要使用玻璃棒引流,故A错误;实验室常用二氧化锰和浓盐酸混合加热制取氯气,必须使用酒精灯加热,氯气的密度比空气大,必须用长进短出排气法收集,短进长出不能赶走集气瓶中的空气,故B错误;NaCl(食盐)是强酸强碱盐,食盐水呈中性,则铁、碳、中性电解质溶液形成原电池,发生吸氧腐蚀,在酸性环境中才可能发生析氢腐蚀,故C错误;氨气极易溶于水,瓶内气体压强迅速减小,瓶内外气体出现很大的压强差,若气球体积迅速增大,说明氨气易溶于水,故D正确。
考点:考查化学实验方案的设计与评价,涉及一定体积一定浓度溶液的配制、实验室制取并收集氯气、钢铁的吸氧腐蚀和析氢腐蚀、氨气的溶解性实验方案的设计与评价。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
用下列实验装置能达到实验目的的是
| A.比较NaHCO3和Na2CO3热稳定性大小 | B.用铜和稀硝酸制取并收集少量NO |
| C.验证氨气在水中溶解度的大小 | D.实验室用氯化铵制少量氨气 |
根据下列实验现象,所得结论错误的是 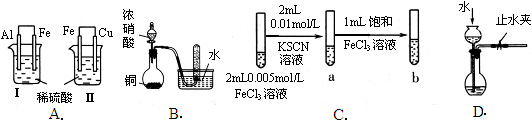
| 实验 | 实验现象 | 结论 |
| A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
| B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
| C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
以下进行性质比较的实验设计,不合理的是
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L¯1NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
下列图示实验合理的是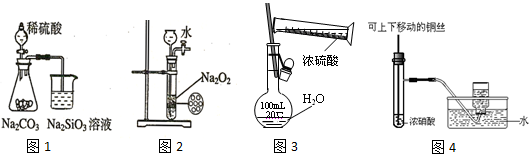
| A.图1为证明非金属性强弱:S>C>Si | B.图2为制备少量氧气 |
| C.图3为配制一定浓度硫酸溶液 | D.图4制备并收集少量NO2气体 |
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀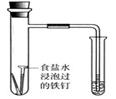 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
下列实验能达到目的的是
| A.用锌与稀硝酸制备H2 |
| B.用酸性KMnO4溶液鉴别1-戊烯和甲苯 |
| C.用丁达尔效应鉴别鸡蛋白溶液和食盐水 |
| D.用水来除去NO2中少量的NO |