题目内容
(14分)水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下: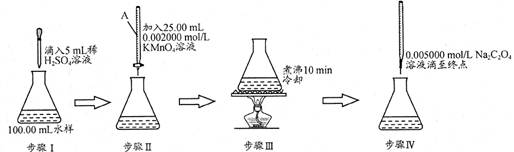
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+ MnO4—+ = Mn2++ CO2↑+
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是 。
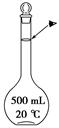
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请在图中标出滴定前的液面。
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时 。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) 。
资料卡片:
1、有机质可HNO3被氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
(14分)
(1)酸式(2分) 紫红色(2分)
(2)5C2O42-+2MnO4?+16H+ = 2Mn2++10CO2+8H2O(2分)
随着反应的进行,生成的Mn2+可做该反应的催化剂(2分)
(4)俯视刻度线(2分,答“视线不水平”或“读数不准确”给1分;答“仰视刻度线”不给分)
(5)在步骤出I的水样中加入适量的Ag2SO4溶液(2分,其它合理答案也可给分)
解析试题分析:(1)KMnO4具有强氧化性,应盛放在酸式滴定管中;KMnO4溶液的颜色为紫红色。
(2)根据氧化还原反应化合价升高的总价数等于化合价降低的总价数,Mn由+7价转化为+2价,降低5价,C2O42-中C为+3价,转化为CO2,共升高了2价,配平可得:5C2O42-+2MnO4?+16H+ = 2Mn2++10CO2+8H2O;滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,化学反应速率加快的原因为:随着反应的进行,生成的Mn2+可做该反应的催化剂。
(3)所用Na2C2O4溶液为20.00ml,所以滴定前的液面向上移动20.00ml。
(4)定容时俯视刻度线,溶液的体积偏小,所配制溶液的浓度偏大,所以实验测量结果比实际有机物含量偏高。
(5)若猜想1成立,若消除Cl—影响,需要除去Cl?,AgNO3溶液、KMnO4溶液、Na2C2O4溶液会发生氧化还原反应造成误差,所以选用Ag2SO4溶液除去Cl?。
考点:本题考查基本仪器、基本操作、氧化还原反应的配平、误差分析、除杂。

 综合自测系列答案
综合自测系列答案下列实验操作中正确的是( )
| A.用干燥的pH试纸测定某氯水的pH |
| B.做完银镜反应的试管可以用氨水来洗涤 |
| C.为了除去乙酸乙酯中混有的少量乙酸,加入足量氢氧化钠溶液,充分搅拌后分液 |
| D.如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。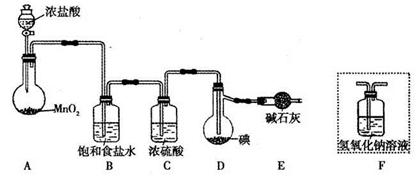
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
i.

ii.ICl+KI=I2+KCl
iii.I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将0.500g该油脂样品溶于10mL四氯化碳后,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol?L—1的Na2S2O3,标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小”)。
③0.500g该油脂样品所消耗的ICl的物质的量为______mol。由此数据经换算即可求得该油脂的不饱和度。
某Na2CO3样品中混有一定量的Na2SO4 (设均不含结晶水),某化学兴趣小组采用两种方案测定该样品中Na2CO3的质量分数,试回答下列问题。
方案一:利用下列方案完成Na2CO3质量分数的測定
(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
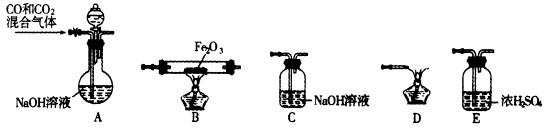
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数:
(4)填写表中空格:
| 仪器 | 试剂 | 加入该试剂的目的 |
| A | | 鼓入空气时洗去CO2 |
| B | | 使样品充分反应放出气体 |
| C | a | |
| D | e | 充分吸收CO2 |
| E | e | |

 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:

 。
。