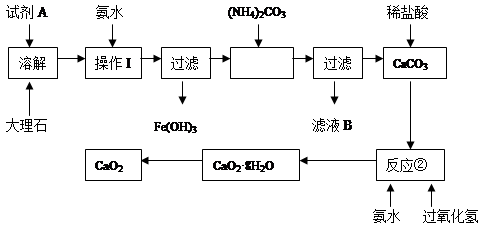
题目内容
化学实验在化学学习中具有重要的作用。
(1)下列与实验有关的叙述正确的是 (填序号)。
①氨水、浓硝酸和溴化银都必须存放在配有磨口塞的棕色玻璃瓶中
②容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水
③用稀盐酸即可鉴别Na2SiO3、NaHCO3、Na[Al(OH)4]、Na2SO4四种溶液
④乙酸与乙醇的混合液可用分液漏斗进行分离
⑤用托盘天平准确称取29.25gNaCl固体,配制500mL0.5mol·L-1 NaCl溶液
(2)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流方向连接下列所有装置(每种装置只允许使用一次),合理的顺序为A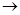 。
。
②装置C的作用是 。
(1)②③ (2)①E→B→C→D ②除去CO中的CO2,有利于点燃CO。
解析试题分析:(1)①氨水呈碱性,不能放在配有磨口塞的棕色玻璃瓶中,错误;②容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水,正确;③将稀盐酸分别滴入Na2SiO3、NaHCO3、Na[Al(OH)4]、Na2SO4四种溶液中,产生的现象分别为产生白色沉淀、产生气体、先产生白色沉淀后消失、无现象,可以鉴别,正确;④乙酸与乙醇互溶,不能用分液漏斗进行分离,应用蒸馏法分离,错误;⑤托盘天平的精确度为0.1g,不能用托盘天平准确称取29.25gNaCl固体,错误。(2)根据实验目的和实验原理进行分析;本实验的目的为用Fe2O3与CO反应来制取单质Fe,分析题给装置知,A装置CO和CO2的混合气体通过NaOH溶液,CO2被吸收,可提供还原剂CO,但CO中含有水蒸气,Fe2O3与CO反应需要加热,所以先通过E装置中的浓硫酸除去水蒸气,CO气体有毒,必须进行尾气处理,用点燃的方法,选D装置,但氧化产物CO2的存在,影响CO的点燃,必须先用C装置中的氢氧化钠溶液除去尾气中CO2,①合理的顺序为A→E→B→C→D ;②装置C的作用是除去CO中的CO2,有利于点燃CO。
考点:考查化学实验基本操作,涉及药品的保存、仪器的使用、物质的鉴别、物质的分离及实验装置的连接。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(6分)下图中A、B、C、D是常见的普通玻璃试剂瓶。请把下列试剂的序号填写在适合盛放的试剂瓶下面的括号内:
a.浓硫酸 b.碳酸钠溶液 c.铝片 d.浓硝酸 e.氢氧化钠溶液 f.二氧化锰
| A | B | C | D |
 |  |  |  |
| ( ) | ( ) | ( ) | ( ) |
(15分)S2Cl2常用于橡胶硫化、有机物氯化的试剂,实验室可利用如下装置来制备S2Cl2。(部分夹持仪器已略去)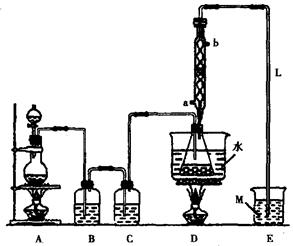
已知:①制备的反应方程式为: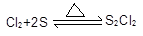
②反应涉及的几种物质性质如下:
| 性质 物质 | 熔点 | 沸点 | 着火点 | 其他性质 |
| 单斜硫 | 119.2℃ | 446.6℃ | 363℃ | / |
| 斜方硫 | 112.8℃ | 446.6℃ | 363℃ | / |
| S2Cl2 | -77℃ | 137℃ | / | 遇水强烈分解生成S、SO2和HCl |
(1)A部分仪器装配时,放好铁架台之后,应先固定 (填仪器名称)。整套装置装配完毕后,应先进行 ,再添加试剂,冷凝水进水口是 (填“a”或“b”)。实验完毕,A中不再产生氯气时,可拆除装置,拆除时,最先进行的操作应是 。
(2)S2Cl2分子中各原子均达到8电子稳定结构,写出其电子式 ;用化学方程式表示撤去C装置的后果 ;用直接加热代替水浴加热的后果是 。
(3)单斜硫、斜方硫互称为 ,从熔点、沸点、着火点等信息得到的启示是 。
(4)M溶液可以选择下列试剂中的 (填序号)
①碳酸钠溶液 ②氯化铁溶液 ③亚硫酸钠溶液 ④高锰酸钾溶液
生铁中除铁外,还含有其他元素,如碳元素和硫元素。其中碳主要以碳化铁的形态存在,它使生铁性能坚硬而脆,所以生铁的用途不大,一般用做炼钢的原料。某兴趣小组设计按下图所示的实验装置,测定生铁中的含碳量。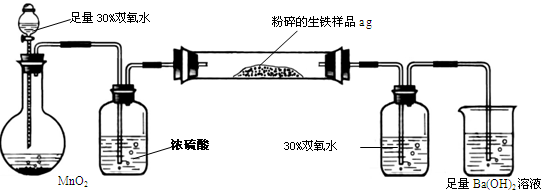
A B C D E
请回答下列问题:
(1)硫在生铁中是有害元素,它使生铁产生热脆性。硫元素在生铁中最有可能存在的价态是
| A.-2 | B.0 | C.+4 | D.+6 |
(3)D中30% 双氧水的作用是 ;若无此装置,所测定的含碳量将 (填“偏高”、“偏低”或“不影响”)
(4)反应完成后,欲验证生铁含有硫元素,你所设计的实验方案是(写出实验步骤、现象) ;
(5)待C管的样品充分反应后,测得E中生成的沉淀为bg,请计算出生铁中的含碳量为 ;
(6)实验过程中,该兴趣小组应注意的安全问题是 。(任写一种)
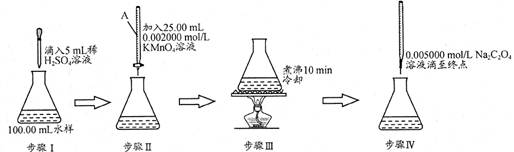
KMnO4溶液常用作氧化还原反应滴定的标准液其还原产物为Mn2+,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:
①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1 h;②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到KMnO4溶液并贮存;④利用氧化还原滴定方法,在70~80 ℃条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。
请回答下列问题:
(1)配制好的KMnO4溶液储存方法是 。准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(2)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(4)若用放置两周的KMnO4标准溶液去测定水样中Fe2+的含量,测得的浓度值将________(填“偏高”、“偏低”或“无影响”)。原因是 。KMnO4与Fe2+反应的离子方程式为 。
某同学进行实验研究时,欲配1.0mol?L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物可能仅为BaCO3,理由是___________________________________。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题纸上进一步完成实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于试管中,_____。 | |
| 步骤4: | |
将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
(3)配制250ml 约0.1mol?L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,__________,将溶液转入_____________,洗涤,定容,摇匀。
(4)滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将__________(填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。 计算Ba(OH)2·8H2O的质量分数=__________________(只列出算式,不做运算)
(5)室温下,________(填“能”或“不能”) 配制1.0 mol?L-1Ba(OH)2溶液。
下列药品和装置合理且能完成相应实验的是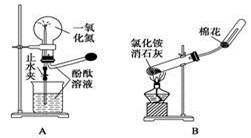
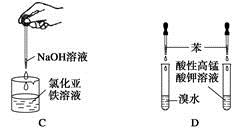
| A.喷泉实验 |
| B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 |
| D.验证苯中是否有碳碳双键 |