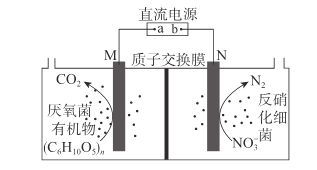
题目内容
【题目】Li、Fe、As均为重要的合金材料,NA为阿伏加德罗常数的值。回答下列问题:
(1)基态Li原子核外电子占据的空间运动状态有________个,占据最高能层电子的电子云轮廓图形状为_________。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为_________。
(3)基态Fe3+比基态Fe2+稳定的原因为____________。
(4)KSCN和K4[Fe(CN)6]均可用于检验Fe3+。
①SCN-的立体构型为_______,碳原子的杂化方式为_____________。
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为__________(用元素符号表示);1 mol [Fe(CN)6]4-中含有σ键的数目为____________。
(5)H3AsO3的酸性弱于H3AsO4的原因为____________________。
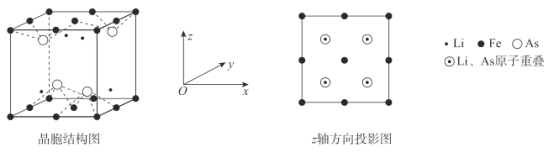
(6)Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度可表示为______g●cm-3。(列式即可)
【答案】2 球形 电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,以光的形式释放能量 基态Fe2+的价层电子排布式为3d6,而基态Fe3+的价层电子排布式为3d5,为半充满状态,稳定性更强 直线形 sp N>C>Fe>K 12NA H3AsO3中非羟基氧原子数小于H3AsO4,砷元素的正电性更小,羟基更不易电离出氢离子 ![]()
【解析】
(1)根据构造原理书写Li核外电子排布式,据此书写基态Li原子核外电子占据的空间运动状态,据此判断Li原子核外占据最高能层电子的电子云轮廓图形状;
(2)焰色反应是是电子跃迁的结果;
(3)原子核外各个轨道电子排布处于全满、半满或全空时是稳定状态;
(4)①根据价层电子对分析,在SCN-中C原子形成了共价三键,据此判断C原子杂化类型;
②元素吸引电子能力越大,其电离能就越大;根据配位体及配位原子中含有的σ键计算;
(5)根据物质中含有的非羟基O原子数目分析;
(6)先根据均摊方法计算一个晶胞中含有的各种元素的原子个数然后根据ρ=![]() 计算密度。
计算密度。
(1)Li核外电子排布式是1s22s1,1个原子轨道为1个空间运动状态,基态Li原子核外电子占据的轨道有1s、2s两个,故有2个空间运动状态。占据最高能层为L层2s轨道,故电子云轮廓图形状为球形;
(2)金属元素产生焰色反应的原因为电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,以光的形式释放多余的能量,形成焰色反应,不同金属元素的电子跃迁时释放的能量不同,因此焰色反应不同;
(3)基态Fe3+的价层电子排布式为3d5,为d轨道的半充满的稳定状态,相对稳定形强,而基态Fe2+的价层电子排布式为3d6,稳定性不如半充满状态;
(4)①SCN-中C原子的价层电子对数目为2,立体构型为直线形,其中碳原子的杂化方式为sp;
②K4[Fe(CN)6]中基态K、Fe、C、N原子吸引电子能力依次增强,第一电离能依次增大;所以四种元素的第一电离能由大到小的顺序为N>C>Fe>K ;Fe2+与CN-形成配位键含6个σ键,每1个CN-中含有1个σ键,所以1mol[Fe(CN)6]4-中含有σ键的数目为12NA;
(5)H3AsO3中非羟基氧原子数是0,而H3AsO4中非羟基氧原子数是1,可见H3AsO3中非羟基氧原子数小于H3AsO4,酸分子中非羟基O原子数目越大,该酸的酸性就越强,且非羟基氧原子数少的酸分子中砷元素的正电性更小,羟基更不易电离出氢离子,故酸性弱于H3AsO4;
(6)由图可知,每个晶胞中含有4个Li、4个As、4个Fe,则该晶体的密度可表示为ρ=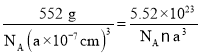 g/cm3。
g/cm3。

【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸___。
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2___(选填“是”或“否”).混合液中离子浓度c(A-)与c(Na+)的大小关系是___。
(3)丙组实验结果分析,HA是___酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=___molL-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1