题目内容
【题目】根据所学知识填空:
(1)实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目;该反应中,氧化产物是 , 还原产物是 , 氧化产物与还原产物的物质的量之比是 .
(2)化学镀镍的溶液中含有Ni2+和H2PO2﹣在酸性条件下发生如下反应,请配平该反应.
Ni2++H2PO2﹣+→ Ni++H2PO3﹣+
【答案】
(1)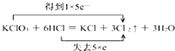 ;Cl2;Cl2;5:1
;Cl2;Cl2;5:1
(2)2;1;H2O;2;1;2H+
【解析】解::(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 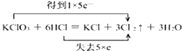 ,该反应中,氧化产物和还原产物都是Cl2 , 其中氧化产物与还原产物的物质的量之比是5:1,所以答案是:
,该反应中,氧化产物和还原产物都是Cl2 , 其中氧化产物与还原产物的物质的量之比是5:1,所以答案是: 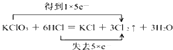 ;Cl2;Cl2;5:1;(2)观察反应式可知镍从+2价变成+1价,化合价降了1,H2PO2﹣中的P为+1价变为H2PO3﹣中的P+3价,化合价升了2,据得失电子总数相等的原则,在镍前需配上系数2,H2PO2﹣前需配上系数1.再据原子个数守恒可知,左边反应物只有两个氧,而右边有三个,因此在反应物中肯定还有一个氧原子,而题目中说,该反应时在酸性条件下进行,所以反应物中应该是水参与了反应,所以可以得出2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ , 所以答案是:2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ .
;Cl2;Cl2;5:1;(2)观察反应式可知镍从+2价变成+1价,化合价降了1,H2PO2﹣中的P为+1价变为H2PO3﹣中的P+3价,化合价升了2,据得失电子总数相等的原则,在镍前需配上系数2,H2PO2﹣前需配上系数1.再据原子个数守恒可知,左边反应物只有两个氧,而右边有三个,因此在反应物中肯定还有一个氧原子,而题目中说,该反应时在酸性条件下进行,所以反应物中应该是水参与了反应,所以可以得出2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ , 所以答案是:2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ .

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目

