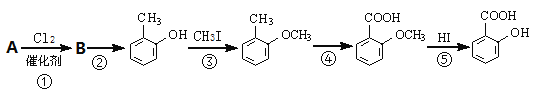
��Ŀ����
����Ŀ����֪���淴Ӧ��M��g����N��g��![]() P��g����Q��g������H>0����ش��������⣺
P��g����Q��g������H>0����ش��������⣺
��1����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊc��M����1 mol��L��1��c��N����2.4 mol��L��1���ﵽƽ���M��ת����Ϊ60%����ʱN��ת����Ϊ________�����¶�ʱ��ƽ�ⳣ��K��________��
��2������Ӧ�¶����ߣ���M��ת����________����������������С����������������
��3������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊc��M����4 mol��L��1��c��N����a mol��L��1���ﵽƽ���c��P����2 mol��L��1����a��________��
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ��Ϊc��M����c��N����b mol��L��1���ﵽƽ���M��ת����Ϊ________��
���𰸡� 25% 0.5 ���� 6 41%
��������������Ҫ�������ƽ�ⳣ���ļ��㡣
��1��ƽ��Ũ�ȣ�c��M����0.4mol��L��1��c��N����1.8mol��L��1��c��P����0.6mol��L��1��c��Q����0.6mol��L��1����ʱN��ת����Ϊ0.6/2.4=25%�����¶�ʱ��ƽ�ⳣ��K��c��P��c��Q��/[c��M��c��N��]=0.5��
��2������Ӧ�¶����ߣ�ƽ�����ƣ���M��ת��������
��3������Ӧ�¶Ȳ��䣬K��22/(4-2)(a-2)=0.5,��a��6��
��4������Ӧ�¶Ȳ��䣬��Mת��cmol/L��K��c2/(b-c)2=0.5��2.41c=b��M��ת����Ϊc/2.41c=41%��

 ��У����ϵ�д�
��У����ϵ�д�