题目内容
将32g铜与一定浓度的硝酸反应.
(1)假设硝酸的还原产物全部是NO2,当铜完全溶解后,试计算产生的NO2气体在标准状况下的体积.
(2)假设硝酸的还原产物既有NO,还有NO2,产生的混合气体在标准状况下的体积为11.2L.试计算NO和NO2的体积分别是多少升?
(1)假设硝酸的还原产物全部是NO2,当铜完全溶解后,试计算产生的NO2气体在标准状况下的体积.
(2)假设硝酸的还原产物既有NO,还有NO2,产生的混合气体在标准状况下的体积为11.2L.试计算NO和NO2的体积分别是多少升?
考点:化学方程式的有关计算
专题:计算题
分析:(1)n(Cu)=
=0.5mol,发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,以此计算;
(2)发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(气体)=
=0.5mol,利用电子守恒及原子守恒计算.
| 32g |
| 64g/mol |
(2)发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(气体)=
| 11.2L |
| 22.4L/mol |
解答:
解:(1)n(Cu)=
=0.5mol,由Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O可知,n(NO2)=2n(Cu)=1mol,标况下体积为1mol×22.4L/mol=22.4L,
答:产生的NO2气体在标准状况下的体积为22.4L;
(2)发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(气体)=
=0.5mol,设NO、NO2的物质的量分别为x、y,由电子守恒及原子守恒可知,
,解得x=0.25mol,y=0.25mol,标况下体积均为0.25mol×22.4L/mol=5.6L,
答:NO和NO2的体积均为5.6L.
| 32g |
| 64g/mol |
答:产生的NO2气体在标准状况下的体积为22.4L;
(2)发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(气体)=
| 11.2L |
| 22.4L/mol |
|
答:NO和NO2的体积均为5.6L.
点评:本题考查化学反应方程式及氧化还原反应的计算,为高频考点,把握电子守恒、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
用下列实验装置进行相应实验,能达到实验目的是( )
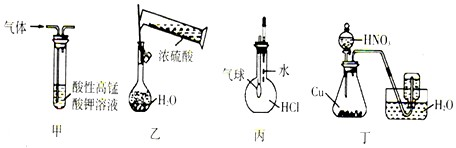

| A、装置甲:除去乙烯中混有的少量SO2 |
| B、装置乙:用浓硫酸配制1mol/L的硫酸 |
| C、装置丙:检验HCl气体在水中的溶解性 |
| D、装置丁:用铜和浓硝酸反应制取NO2 |
下列有关实验操作正确的是( )
| A、用Ba(NO3)2溶液可以鉴别SO32-和SO42- |
| B、做H2还原CuO实验时要先通氢气,验纯后再加热 |
C、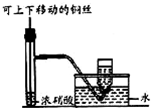 采用如图所示装置可制备并收集少量NO2气体 |
| D、测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸 |
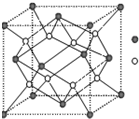 A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)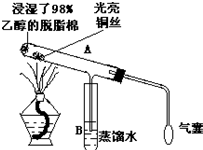 有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图:
有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图: 与Br2发生1:1加成反应,其可能的加成产物的结构简式有:
与Br2发生1:1加成反应,其可能的加成产物的结构简式有: (1)在蔗糖中加入浓H2SO4,反应的化学方程式为
(1)在蔗糖中加入浓H2SO4,反应的化学方程式为