题目内容
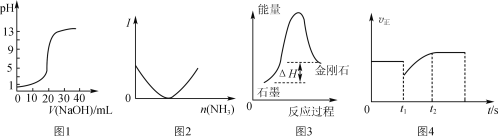
【题目】已知反应H2(g)+ ![]() O2(g)=H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是 ( )
O2(g)=H2O(g)的能量变化如图所示,a、b、c表示能量变化,为正值,单位为kJ,下列说法正确的是 ( )
A. H2(g)+ ![]() O2(g)=H2O(g) △H=c kJ·mol-1
O2(g)=H2O(g) △H=c kJ·mol-1
B. 2H2O(g)=2H2 (g)+O2 (g) △H=—2(a-b) kJ·mol-1
C. 1 mol氢气与0.5 mol氧气总能量为akJ
D. 2 mol氢气与1 mol氧气完全反应生成2 mol液态水放出的热量小于2(b-a)kJ
【答案】B
【解析】A、反应物的能量更高,该反应为放热反应,△H=-c kJ·mol-1,A错误。B、2molH2O逆向分解时,共吸收2bkJ能量,又释放2akJ能量得到产物,△H=-2(a-b) kJ·mol-1,B正确。C、图中标示了1 mol氢气与0.5 mol氧气总能量,但是在纵坐标中没有具体可用的读数,akJ 是由此变化到气态原子时的能量变化,C错误。D、如果反应生成液态水,释放的能量更大,所以2 mol氢气与1 mol氧气完全反应生成2 mol液态水放出的热量大于2(b-a)kJ,D错误。正确答案B。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中不正确的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
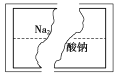
选项 | 预测物质的化学式 | 预测所需指示剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,则原溶液是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A. A B. B C. C D. D