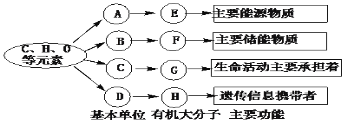
题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
D. 化学反应中每生成1molO2,转移的电子数为4NA
【答案】C
【解析】A、HF在标准状况下是液体,不是气体,故A错误;B、因为是某温度下,不清楚水的离子积多少,无法计算OH-物质的量,故B错误;C、丙烯和环丙烷分子式都是C3H6,丙烯的结构简式为CH2=CHCH3,因此42g丙烯含有的共用电子对的物质的量为42×9/42mol=9mol,环丙烷的结构简式为![]() ,因此42g环丙烷含有共用电子对的物质的量为42×9/42mol=9mol,故C正确;D、如果是H2O2→O2,因此生成1molO2转移电子物质的量为2mol,故D错误。
,因此42g环丙烷含有共用电子对的物质的量为42×9/42mol=9mol,故C正确;D、如果是H2O2→O2,因此生成1molO2转移电子物质的量为2mol,故D错误。

 名校课堂系列答案
名校课堂系列答案【题目】图1所示的氮循环是生态系统物质循环的重要组成部分,人类活动加剧了氮循环中的物质转化。
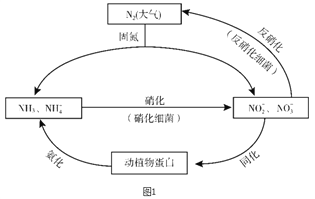
(1)结合上图判断下列说法正确的是________(填字母序号)。
A. 固氮过程中,N2只做氧化剂
B. 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C. 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D. 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的反应的化学方程式为_______。
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:5CH3OH + 6NO3- ![]() N2↑ + 4HCO3- +□______+□
N2↑ + 4HCO3- +□______+□
(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:_______。
共价键 | N≡N | H—H | N—H |
断开1mol共价键所需能量(kJ) | 946 | 436 | 391 |
(5)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图2和图3所示。
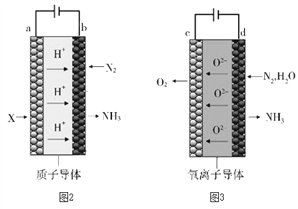
①图2中,a电极上通入的X为_______。
②图3中,d电极上的电极反应式为_______。
③若图2和图3装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。