题目内容
20.已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如图1所示(水和部分反应物及产物已略去).其中,丁是一种红褐色沉淀,戊是一种白色沉淀.请回答下列问题: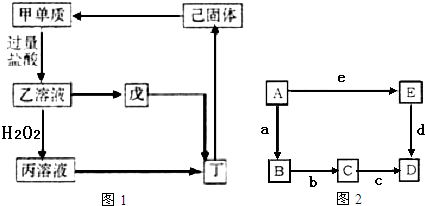
(1)写出戊→丁的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)在乙溶液中加入H2O2溶液后,观察到的现象是溶液颜色由浅绿色转为黄色;写出此反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;如果在乙溶液中加入其它试剂,也可以实现与加入H2O2相同的转化,且不会引入新的杂质离子,该反应的离子方程式是:2Fe2++Cl2═2Fe3++2Cl-;
(3)已知丙溶液具有止血作用,其原理是血液是一种胶体,FeCl3是一种电解质,二者相遇后发生聚沉而使血液凝固.
(4)已知图2中的A单质一种金属,可以实现图1中“己固体→甲单质”的转化,B、C、D、E中都含A元素,它们之间的转化关系如图2所示(水和部分反应及产物已略去):已知B是常见的两性氧化物,a为单质;c为一种弱碱;b为一种强酸;d为一种氧化物;e为一种强碱,其焰色为透过蓝色钴玻璃观察为紫色.
①写出化学式:aO2cNH3•H2OdCO2eKOH;
②写出C→D的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+;写出E→D的离子方程式Al(OH)-4+CO2=Al(OH)3↓+HCO3-.
分析 丁是一种红褐色沉淀,为Fe(OH)3,甲、乙、丙、丁、戊、己六种物质中含同一种元素,则单质甲为Fe,与过量的盐酸反应生成乙为FeCl2,戊是一种白色沉淀,则戊为Fe(OH)2,乙与过氧化氢反应得到丙为FeCl3,(4)图2中的A单质一种金属,可以实现图1中“己固体→甲单质”的转化,B、C、D、E中都含A元素,已知B是常见的两性氧化物,a为单质;c为一种弱碱;b为一种强酸;d为一种氧化物;e为一种强碱,其焰色为透过蓝色钴玻璃观察为紫色,则e为KOH,A为Al,a为O2,B为Al2O3,E为NaAlO2,d为CO2,D为Al(OH)3,C为铝盐,c为NH3•H2O.
解答 解:丁是一种红褐色沉淀,为Fe(OH)3,甲、乙、丙、丁、戊、己六种物质中含同一种元素,则单质甲为Fe,与过量的盐酸反应生成乙为FeCl2,戊是一种白色沉淀,则戊为Fe(OH)2,乙与过氧化氢反应得到丙为FeCl3.
(1)戊→丁的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)在乙溶液中加入H2O2溶液后,亚铁离子被氧化为铁离子,观察到的现象是:溶液颜色由浅绿色转为黄色,该反应的离子方程式是:2Fe2++H2O2+2H+=2Fe3++2H2O,如果在乙溶液中加入其它试剂,也可以实现与加入H2O2相同的转化,且不会引入新的杂质离子,应是通入氯气,该反应的离子方程式是:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:溶液颜色由浅绿色转为黄色;2Fe2++H2O2+2H+=2Fe3++2H2O;2Fe2++Cl2═2Fe3++2Cl-;
(3)血液是一种胶体,FeCl3是一种电解质,二者相遇后发生聚沉而使血液凝固,
故答案为:血液是一种胶体,FeCl3是一种电解质,二者相遇后发生聚沉而使血液凝固;
(4)图2中的A单质一种金属,可以实现图1中“己固体→甲单质”的转化,B、C、D、E中都含A元素,已知B是常见的两性氧化物,a为单质;c为一种弱碱;b为一种强酸;d为一种氧化物;e为一种强碱,其焰色为透过蓝色钴玻璃观察为紫色,则e为KOH,A为Al,a为O2,B为Al2O3,E为NaAlO2,d为CO2,D为Al(OH)3,C为铝盐,c为NH3•H2O.
①a为O2,c为NH3•H2O,d为CO2,e为KOH,
故答案为:O2;NH3•H2O;CO2;KOH;
②C→D的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,E→D的离子方程式:Al(OH)-4+CO2=Al(OH)3↓+HCO3-,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;Al(OH)-4+CO2=Al(OH)3↓+HCO3-.
点评 本题考查无机物推断,涉及Fe、Al元素化合物性质与转化,根据丁为红褐色沉淀推断,需要学生熟练掌握元素单质化合物性质,题目难度中等.

| A. | 原子半径依次增大 | B. | 气态氢化物的稳定性依次减弱 | ||
| C. | 气态氢化物水溶液的酸性依次减弱 | D. | 气态氢化物的还原性依次增强 |
| A. | 不改变 | B. | 逐渐减小 | C. | 逐渐增大 | D. | 先减小,后增大 |
| A. | Mg、Al | B. | Fe、Zn | C. | Mg、Cu | D. | Al、Fe |
| A. | ①②③ | B. | ①④ | C. | ①③ | D. | ①②③④ |
| A. | 1.7gOH-所含电子数为0.9NA | |
| B. | 标准状况下,11.2LHCl 所含质子数为18NA | |
| C. | 常温下,11.2LCl2所含原子数为NA | |
| D. | 0.5molD2O中所含质子数为5NA |
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的气态氢化物的热稳定性依次递减 | |
| B. | 液态WX3气化需克服分子间作用力 | |
| C. | 根据元素周期律,可以推测T元素的单质具有半导体特性 | |
| D. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
 ,
,
 .
. .
.