题目内容
9.在稀硫酸环境中,KC1O3为氧化剂氧化Mn2+,当生成0.05mol MnO2时,消耗0.1mol/L的KC1O3溶液200mL,该反应的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.分析 以KClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol•L-1 的KClO3溶液200mL,二者发生氧化还原反应,依据得失电子守恒、原子个数守恒判断反应生成物,据此写出离子方程式.
解答 解:以KClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol•L-1 的KClO3溶液200mL,设还原产物中Cl的化合价为x,
则由电子守恒可知,0.05mol×(4-2)=0.1mol/L×0.2L×(5-x),解得x=0,即生成氯气,则离子反应为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+,
故答案为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应的离子方程式的书写,明确得失电子守恒规律是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.有人设想合成具有以下结构的烃分子,下列说法不正确的是( )
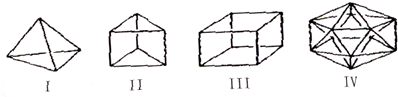

| A. | Ⅳ不可能合成得到 | B. | Ⅱ与苯互为同分异构体 | ||
| C. | Ⅲ(立方烷)的六氯代物共有3种 | D. | Ⅰ中各键之间夹角为109°28′ |
20.下列物质属于电解质的是( )
| A. | CO2 | B. | Al | C. | 食盐水 | D. | BaSO4 |
4.用NA表示阿伏加德罗常数的值,下列有关说法不正确的是( )
| A. | 标准状况下,22.4LN2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2g H2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子 | |
| D. | 1L1mol•L-1的氨水,含NA个NH3•H2O |
1.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
| A. | 1种 | B. | 2种 | C. | 3 种 | D. | 4种 |


 中的官能团有 (填名称)
中的官能团有 (填名称)
 )是合成一种抗早产药物的重要中间体。根据已有知识并结合相关信息,写出以CH3Br和
)是合成一种抗早产药物的重要中间体。根据已有知识并结合相关信息,写出以CH3Br和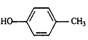 为有机原料(无机试剂和反应条件任选)合成E的路线流程图。合成路线流程图示例如下:
为有机原料(无机试剂和反应条件任选)合成E的路线流程图。合成路线流程图示例如下: