题目内容
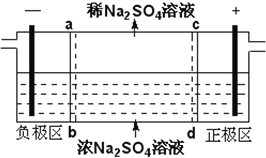
【题目】下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:

①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
【答案】正 O2-+NO-2e-=NO2 Cu 1
【解析】
①得电子发生还原反应的电极为正极,失电子发生氧化反应的电极为负极;
②根据图知,a为正极、b为负极,电解硫酸铜溶液时,m为阳极、n为阴极;根据电路中电子守恒进行计算。
①据图可知a极通入氧气,氧气只能得电子发生还原反应,所以a为正极,b为负极,NO失电子被氧化生成NO2,电解质为固态,氧离子在负极参与反应,电极方程式为:O2-+NO-2e-=NO2,故答案为:正;O2-+NO-2e-=NO2;
②根据图知,a为正极、b为负极,电解氯化钠溶液时,m为阳极、n为阴极,根据电池反应式2NaCl+2H2O H2↑+Cl2↑+2NaOH,在标准状况下,若通入112mL的O2,n(O2)=
H2↑+Cl2↑+2NaOH,在标准状况下,若通入112mL的O2,n(O2)=![]() =0.005mol,转移的电子为0.005mol×2=0.02mol,电解池中每转移2mol电子生成2molNaOH,则电解后生成NaOH0.02mol,浓度为
=0.005mol,转移的电子为0.005mol×2=0.02mol,电解池中每转移2mol电子生成2molNaOH,则电解后生成NaOH0.02mol,浓度为![]() =0.1mol/L,则溶液pH=13,故答案为:13;
=0.1mol/L,则溶液pH=13,故答案为:13;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目