题目内容
【题目】I.炒过菜的铁锅为及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢“或“吸氧”)。
(2)写出铁锅腐蚀时正极的电极反应式: 。
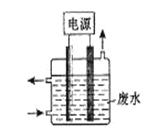
II.①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
【答案】I.(1)吸氧;(2)2H2O+O2+4e-=4OH- II.①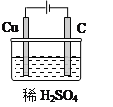
②两极与电源的正负极接反了,或铜棒接电源的负极了等。
【解析】
试题分析:(1)①弱碱或者中性条件下,钢铁发生吸氧腐蚀。
②正极发生还原反应,氧气得电子变成氢氧根离子,方程式为:2H2O+O2+4e-=4OH-;
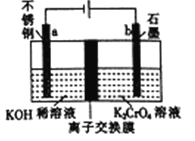
(2)①铜和稀硫酸不反应,要实现该反应,需要通过电解,装置如图所示: 。
。
②当两极与电池的正负极接反了之后,该电解池就相当于电解水,正负极都会有气泡产生,而且铜不会被腐蚀。

练习册系列答案
相关题目